Termofysiikan perusteet, Ismo Napari ja Hanna Vehkamäki, 2013.
Termofysiikan perusteet, Ismo Napari ja Hanna Vehkamäki, 2013.
Termofysiikan perusteet, Ismo Napari ja Hanna Vehkamäki, 2013.
- No tags were found...
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
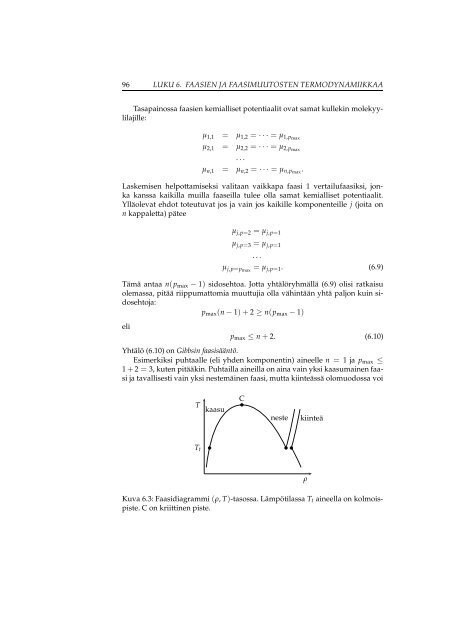
96 LUKU 6. FAASIEN JA FAASIMUUTOSTEN TERMODYNAMIIKKAATasapainossa faasien kemialliset potentiaalit ovat samat kullekin molekyylilajille:µ 1,1 = µ 1,2 = ··· = µ 1,pmaxµ 2,1 = µ 2,2 = ··· = µ 2,pmax. . .µ n,1 = µ n,2 = ··· = µ n,pmax .Laskemisen helpottamiseksi valitaan vaikkapa faasi 1 vertailufaasiksi, jonkakanssa kaikilla muilla faaseilla tulee olla samat kemialliset potentiaalit.Ylläolevat ehdot toteutuvat jos <strong>ja</strong> vain jos kaikille komponenteille j (joita onn kappaletta) päteeµ j,p=2 = µ j,p=1µ j,p=3 = µ j,p=1. . .µ j,p=pmax = µ j,p=1 . (6.9)Tämä antaa n(p max − 1) sidosehtoa. Jotta yhtälöryhmällä (6.9) olisi ratkaisuolemassa, pitää riippumattomia muuttujia olla vähintään yhtä paljon kuin sidosehto<strong>ja</strong>:p max (n−1)+2 ≥ n(p max − 1)elip max ≤ n+2. (6.10)Yhtälö (6.10) on Gibbsin faasisääntö.Esimerkiksi puhtaalle (eli yhden komponentin) aineelle n = 1 <strong>ja</strong> p max ≤1+2 = 3, kuten pitääkin. Puhtailla aineilla on aina vain yksi kaasumainen faasi<strong>ja</strong> tavallisesti vain yksi nestemäinen faasi, mutta kiinteässä olomuodossa voiTkaasuCnestekiinteäT tρKuva 6.3: Faasidiagrammi(ρ, T)-tasossa. Lämpötilassa T t aineella on kolmoispiste.C on kriittinen piste.