- Page 1 and 2:
TermofysiikanperusteetIsmo Napari j
- Page 3 and 4:
SISÄLTÖiii4.6 Entropia (5.3) . .
- Page 5 and 6:
Luku 1Johdanto1.1 Termofysiikan osa
- Page 7 and 8:
1.3. IDEAALIKAASUN TILANYHTÄLÖ (1
- Page 9 and 10:
1.3. IDEAALIKAASUN TILANYHTÄLÖ (1
- Page 11 and 12:
1.4. ESIMERKKEJÄ TILANYHTÄLÖIST
- Page 13 and 14:
2.2. LÄMPÖMITTARIT JA LÄMPÖTILA
- Page 15 and 16:
2.2. LÄMPÖMITTARIT JA LÄMPÖTILA
- Page 17 and 18:
3.1. TYÖ (2.2, 2.7) 13ten, että j
- Page 19 and 20:
3.2. EKSAKTIT JA EPÄEKSAKTIT DIFFE
- Page 21 and 22:
3.2. EKSAKTIT JA EPÄEKSAKTIT DIFFE
- Page 23 and 24:
3.3. TERMODYNAMIIKAN ENSIMMÄINEN P
- Page 25 and 26:
3.4. LÄMPÖKAPASITEETIT (2.5) 21Er
- Page 27 and 28:
3.5. KVASISTAATTISIA IDEAALIKAASUPR
- Page 29 and 30:
3.5. KVASISTAATTISIA IDEAALIKAASUPR
- Page 31 and 32:
3.5. KVASISTAATTISIA IDEAALIKAASUPR
- Page 33 and 34:
Luku 4Termodynamiikan toinenpääs
- Page 35 and 36:
4.1. TOINEN PÄÄSÄÄNTÖ JA CARNO
- Page 37 and 38:
4.1. TOINEN PÄÄSÄÄNTÖ JA CARNO
- Page 39 and 40:
4.3. CARNOT’N JÄÄKAAPPI JA LÄM
- Page 41 and 42:
4.4. IDEAALIKAASUKONEITA (5.2) 3754
- Page 43 and 44:
4.4. IDEAALIKAASUKONEITA (5.2) 39el
- Page 45 and 46:
4.5. CLAUSIUKSEN EPÄYHTÄLÖ (5.6)
- Page 47 and 48:
4.6. ENTROPIA (5.3) 43Systeemid¯W
- Page 49 and 50:
4.6. ENTROPIA (5.3) 45Adiabaattises
- Page 51 and 52:
4.7. SISÄINEN ENERGIA JA MAXWELLIN
- Page 53 and 54:
4.7. SISÄINEN ENERGIA JA MAXWELLIN
- Page 55 and 56:
4.8. ESIMERKKEJÄ ENTROPIAN MUUTOKS
- Page 57 and 58:
4.8. ESIMERKKEJÄ ENTROPIAN MUUTOKS
- Page 59 and 60:
4.9. ENTROPIAN DIFFERENTIAALI JA ER
- Page 61 and 62:
4.9. ENTROPIAN DIFFERENTIAALI JA ER
- Page 63 and 64:
4.11. TERMODYNAMIIKAN PÄÄSÄÄNN
- Page 65 and 66:
4.12. PISARAN TARINA, OSA 1: TAUSTA
- Page 67 and 68:
4.12. PISARAN TARINA, OSA 1: TAUSTA
- Page 69 and 70:
4.12. PISARAN TARINA, OSA 1: TAUSTA
- Page 71 and 72:
5.2. YMPÄRISTÖN KANSSA VUOROVAIKU
- Page 73 and 74:
5.2. YMPÄRISTÖN KANSSA VUOROVAIKU
- Page 75 and 76: 5.2. YMPÄRISTÖN KANSSA VUOROVAIKU
- Page 77 and 78: 5.3. VAPAAT ENERGIAT JA NIIDEN TASA
- Page 79 and 80: 5.3. VAPAAT ENERGIAT JA NIIDEN TASA
- Page 81 and 82: 5.4. MIKSI TERMODYNAAMISIA POTENTIA
- Page 83 and 84: 5.4. MIKSI TERMODYNAAMISIA POTENTIA
- Page 85 and 86: 5.4. MIKSI TERMODYNAAMISIA POTENTIA
- Page 87 and 88: 5.4. MIKSI TERMODYNAAMISIA POTENTIA
- Page 89 and 90: 5.5. PISARAN TARINA, OSA 2: VAPAAN
- Page 91 and 92: 5.5. PISARAN TARINA, OSA 2: VAPAAN
- Page 93 and 94: Luku 6Faasien ja faasimuutostenterm
- Page 95 and 96: 6.3. STABIILISUUS 91Kuva 6.1: Vakaa
- Page 97 and 98: 6.4. FAASIDIAGRAMMI JA GIBBSIN FAAS
- Page 99 and 100: 6.4. FAASIDIAGRAMMI JA GIBBSIN FAAS
- Page 101 and 102: 6.5. FAASIMUUTOKSEN KERTALUKU 97esi
- Page 103 and 104: 6.6. VAPAA ENERGIA-DIAGRAMMIT (8.1)
- Page 105 and 106: 6.7. CLAUSIUKSEN JA CLAPEYRONIN YHT
- Page 107 and 108: 6.7. CLAUSIUKSEN JA CLAPEYRONIN YHT
- Page 109 and 110: 6.8. FAASIMUUTOKSET JA VAN DER WAAL
- Page 111 and 112: 6.8. FAASIMUUTOKSET JA VAN DER WAAL
- Page 113 and 114: 6.8. FAASIMUUTOKSET JA VAN DER WAAL
- Page 115 and 116: 6.8. FAASIMUUTOKSET JA VAN DER WAAL
- Page 117 and 118: 6.9. PISARAN TARINA, OSA 3: TASAPAI
- Page 119 and 120: 6.9. PISARAN TARINA, OSA 3: TASAPAI
- Page 121 and 122: 6.9. PISARAN TARINA, OSA 3: TASAPAI
- Page 123 and 124: 6.9. PISARAN TARINA, OSA 3: TASAPAI
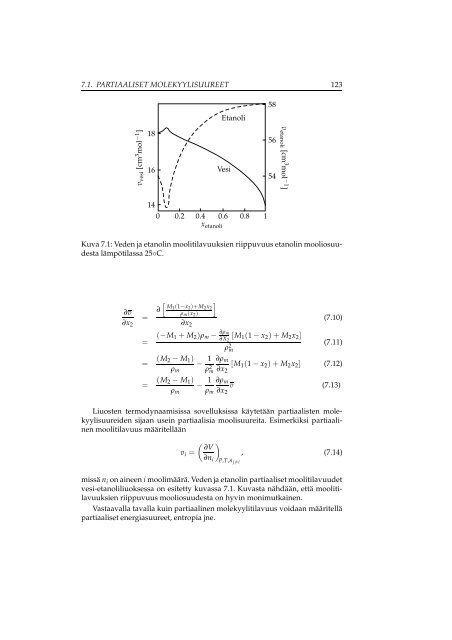
- Page 125: Luku 7Liuosten termodynamiikkaa7.1
- Page 129 and 130: 7.2. LAIMEIDEN LIUOSTEN HÖYRYNPAIN
- Page 131 and 132: 7.3. OSMOOSI 127lisessä kappaleess
- Page 133: 129eliValitaan ensin dx ̸= 0 ja dz