Visualizza / Stampa - IDEXX Laboratories
Visualizza / Stampa - IDEXX Laboratories
Visualizza / Stampa - IDEXX Laboratories
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
2 Istruzioni di carattere generale<br />
2.5 Istruzioni di carattere generale per esami istologici<br />
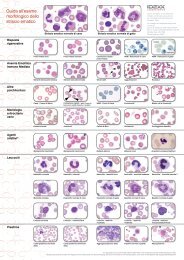
Aspirato con ago sottile di masse o liquidi<br />
Per la punzione si consiglia un ago di 18 - 22 G e di corrispondente lunghezza. Per una<br />
punzione sicura e ripetuta si consiglia l'uso di un supporto di aspirazione (impugnatura<br />
supplementare per siringhe e/o pistola aspirante). Altrimenti, utilizzare siringhe da 5 - 10 ml.<br />
Il prelievo del materiale avviene tramite una breve aspirazione a cannula inserita e con lo<br />
stantuffo della siringa sollevato di circa 2 ml. Se necessario si ripete la punzione più volte,<br />
sempre con una nuova cannula. Evitare tuttavia di campionare più volte con forza a raggiera o<br />
di aspirare in modo continuo per un lungo periodo di tempo, dal momento che ciò può portare<br />
a contaminazione eccessiva di sangue. In caso di punzione di masse in genere, il materiale<br />
dovrebbe trovarsi nella sola cannula e non essere visibile nel corpo della siringa. Dopo aver<br />
leggermente ridotto la depressione ed estratta quindi la cannula, il materiale ottenuto deve<br />
venire rapidamente disposto su un vetrino portaoggetti, distribuendolo in modo simile ad uno<br />
striscio ematico. Una quantità ridotta di materiale può essere disposta a stella con la punta<br />
della cannula. Per il prelievo dei linfonodi si suggerisce di evitare l'aspirazione: è sufficiente<br />
l'ago infissione. Le cellule linfoidi, in particolare quelle reattive o blastiche, sono molto delicate.<br />
I liquidi devono prima venire centrifugati a 1500 giri/min. per 5 minuti (il trattamento minimo è<br />
di 3 minuti a 800 giri/min.). Dopo aver asportato con una pipetta il surnatante, stendere su un<br />
vetrino il sedimento (il sedimento assieme ad una residua parte di surnatante liquido deve essere<br />
delicatamente agitato per ottenere una sospensione cellulare) come per uno striscio ematico.<br />
Lo striscio ottenuto viene quindi asciugato all'aria e, una volta essiccato, può essere inserito<br />
nel relativo contenitore protettivo e inviato al nostro laboratorio. Non coprire mai con un vetrino<br />
di copertura o con un secondo vetrino portaoggetto e non utilizzate fissanti né coloranti.<br />
Per l'anamnesi, è particolarmente importante, soprattutto negli esami citologici, l'indicazione<br />
del sito di prelievo.<br />
Informazioni sul prezzo<br />
In caso di campioni tissutali di grandi dimensioni, di tumori multipli o di più campioni diversi di<br />
un unico animale, nonché in caso di campioni ricavati da più di 5 biopsie cutanee dello<br />
stesso animale, a causa dell'aumentato volume di lavoro con numero sensibilmente maggiore<br />
di preparati e tagli e di diverse interpretazioni e diagnosi, viene addebitato un supplemento di<br />
prezzo (cfr. Listino prezzi).<br />
In caso di domande Vi invitiamo a contattare il nostro numero verde 800 011 822<br />
22<br />
2.6 Istruzioni di carattere generale per esami parassitologici<br />
Prelievo ed invio del campione<br />
Il campione di feci per un esame parassitologico deve, se possibile, venire prelevato direttamente<br />
dal retto. In caso di campioni non rettali devono essere utilizzate feci fresche. La raccolta di feci<br />
dal suolo può dare luogo ad una contaminazione secondaria.<br />
Per ottenere un risultato significativo è necessaria una quantità minima del campione (indicata<br />
per ogni singolo esame).<br />
I campioni devono venire inviati al laboratorio immediatamente dopo il prelievo in confezioni<br />
chiuse ermeticamente ed infrangibili, se possibile refrigerati.<br />
Se la spedizione di campioni subisce ritardi, il materiale di analizzare deve essere conservato in<br />
frigorifero. In questo modo non viene compromessa la vitalità delle larve e si impedisce l'ulteriore<br />
sviluppo di oocisti e uova.<br />
Inviare i parassiti, o le loro parti espulse insieme alle feci, in stato naturale (non fissati con<br />
formalina!) o in una piccola quantità di soluzione salina fisiologica in una provetta distinta dal<br />
campione di feci.<br />
Interpretazione dei referti parassitologici<br />
2 Istruzioni di carattere generale<br />
Ogni procedura presenta i suoi limiti di rilevazione. Solo un referto positivo (rilevazione diretta<br />
dell'agente patogeno) ha funzione di prova, un referto negativo non esclude però un'infezione<br />
parassitaria. Talvolta sono necessari esami seriali per la rilevazione dell'agente patogeno.<br />
L'espulsione dei vari stadi di sviluppo dei parassiti ha luogo in modo intermittente ed in alcuni<br />
casi anche in quantità modesta: per questo motivo si consiglia di analizzare un campione di<br />
feci collettivo di 3 giorni. Negli allevamenti (eccezioni: suini da ingrasso e volatili) si deve<br />
raccogliere a random un numero rappresentativo di campioni (non campioni collettivi di più<br />
animali!).<br />
La rilevazione degli stadi di sviluppo dei parassiti è possibile solo in caso di infestazioni palesi<br />
(le infestazioni nei primi e negli ultimi stadi non vengono rilevate!). Questo è molto importante<br />
per determinate infestazioni parassitarie, in cui i sintomi si verificano già nel periodo di<br />
prepatenza.<br />
23