urn:nbn:de:hbz:468-20130312-112320-7 - Bergische Universität ...
urn:nbn:de:hbz:468-20130312-112320-7 - Bergische Universität ...
urn:nbn:de:hbz:468-20130312-112320-7 - Bergische Universität ...
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
26<br />
Die Funktionalisierung für die anschließen<strong>de</strong> Stille-Kreuzkupplungsreaktion zu<br />
PCPDTTBTT kann durch eine Dibromierung o<strong>de</strong>r Diiodierung erfolgen. Die Halogenierung<br />
wur<strong>de</strong> dabei mit N-Bromsuccinimid bzw. N-Iodsuccinimid durchgeführt. Für die<br />
Halogenierungen wer<strong>de</strong>n in <strong>de</strong>r Literatur viele verschie<strong>de</strong>ne Reaktionsbedingungen und<br />
Lösungsmittel genannt. In dieser Arbeit wur<strong>de</strong> N-Bromsuccinimid bei -78°C zu einer Lösung<br />
von 14 in Tetrahydrofuran zugegeben und die Reaktionsmischung anschließend 36 Stun<strong>de</strong>n<br />
bei Raumtemperatur gerührt [69] während die Iodierung in Chloroform mit wenig Essigsäure<br />
über Nacht bei 75°C durchgeführt wur<strong>de</strong>. [70] Nach Aufarbeitung und Umkristallisation wur<strong>de</strong><br />
jeweils ein dunkelroter Feststoff mit einer Ausbeute von 53 % (4,7-Di(5-bromthiophen-2-<br />
yl))benzo[c][1,2,5]thiadiazol, 15) bzw. 95 % (4,7-Di(5-iodthiophen-2-yl))benzo[c][1,2,5]thiadiazol,<br />
16) erhalten.<br />
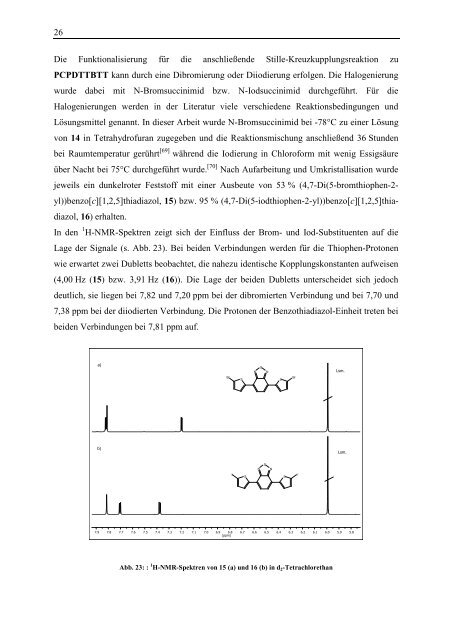
In <strong>de</strong>n 1 H-NMR-Spektren zeigt sich <strong>de</strong>r Einfluss <strong>de</strong>r Brom- und Iod-Substituenten auf die<br />
Lage <strong>de</strong>r Signale (s. Abb. 23). Bei bei<strong>de</strong>n Verbindungen wer<strong>de</strong>n für die Thiophen-Protonen<br />
wie erwartet zwei Dubletts beobachtet, die nahezu i<strong>de</strong>ntische Kopplungskonstanten aufweisen<br />
(4,00 Hz (15) bzw. 3,91 Hz (16)). Die Lage <strong>de</strong>r bei<strong>de</strong>n Dubletts unterschei<strong>de</strong>t sich jedoch<br />
<strong>de</strong>utlich, sie liegen bei 7,82 und 7,20 ppm bei <strong>de</strong>r dibromierten Verbindung und bei 7,70 und<br />
7,38 ppm bei <strong>de</strong>r diiodierten Verbindung. Die Protonen <strong>de</strong>r Benzothiadiazol-Einheit treten bei<br />
bei<strong>de</strong>n Verbindungen bei 7,81 ppm auf.<br />
a)<br />
N<br />
S<br />
N<br />
Lsm.<br />
Br<br />
S<br />
S<br />
Br<br />
b)<br />
Lsm.<br />
N<br />
S<br />
N<br />
I<br />
S<br />
S<br />
I<br />
7.9<br />
7.8<br />
7.7<br />
7.6<br />
7.5<br />
7.4<br />
7.3<br />
7.2<br />
7.1<br />
7.0<br />
6.9 6.8<br />
[ppm]<br />
6.7<br />
6.6<br />
6.5<br />
6.4<br />
6.3<br />
6.2<br />
6.1<br />
6.0<br />
5.9<br />
5.8<br />
Abb. 23: : 1 H-NMR-Spektren von 15 (a) und 16 (b) in d 2 -Tetrachlorethan