urn:nbn:de:hbz:468-20130312-112320-7 - Bergische Universität ...
urn:nbn:de:hbz:468-20130312-112320-7 - Bergische Universität ...
urn:nbn:de:hbz:468-20130312-112320-7 - Bergische Universität ...
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
64<br />
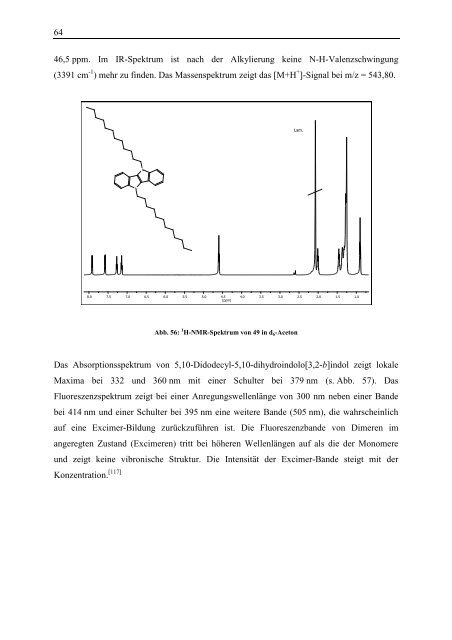
46,5 ppm. Im IR-Spektrum ist nach <strong>de</strong>r Alkylierung keine N-H-Valenzschwingung<br />
(3391 cm -1 ) mehr zu fin<strong>de</strong>n. Das Massenspektrum zeigt das [M+H + ]-Signal bei m/z = 543,80.<br />
Lsm.<br />
N<br />
N<br />
8.0 7.5 7.0 6.5 6.0 5.5 5.0 4.5 4.0 3.5 3.0 2.5 2.0 1.5 1.0<br />
[ppm]<br />
Abb. 56: 1 H-NMR-Spektrum von 49 in d 6 -Aceton<br />
Konzentration. [117]<br />
Das Absorptionsspektrum von 5,10-Dido<strong>de</strong>cyl-5,10-dihydroindolo[3,2-b]indol zeigt lokale<br />
Maxima bei 332 und 360 nm mit einer Schulter bei 379 nm (s. Abb. 57). Das<br />
Fluoreszenzspektrum zeigt bei einer Anregungswellenlänge von 300 nm neben einer Ban<strong>de</strong><br />
bei 414 nm und einer Schulter bei 395 nm eine weitere Ban<strong>de</strong> (505 nm), die wahrscheinlich<br />
auf eine Excimer-Bildung zurückzuführen ist. Die Fluoreszenzban<strong>de</strong> von Dimeren im<br />
angeregten Zustand (Excimeren) tritt bei höheren Wellenlängen auf als die <strong>de</strong>r Monomere<br />
und zeigt keine vibronische Struktur. Die Intensität <strong>de</strong>r Excimer-Ban<strong>de</strong> steigt mit <strong>de</strong>r