Polymerisation von Ethylen und 1-Olefinen in wässrigen Medien mit ...
Polymerisation von Ethylen und 1-Olefinen in wässrigen Medien mit ...
Polymerisation von Ethylen und 1-Olefinen in wässrigen Medien mit ...
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
<strong>Ethylen</strong>fluss <strong>in</strong> den Reaktor<br />
(normiert auf die Katalysatore<strong>in</strong>waage)<br />
[10 3 -1 -1<br />
mol mol h ]<br />
(<strong>Ethylen</strong>) (Nickel)<br />
100<br />
80<br />
60<br />
Aktivierung <strong>von</strong> Salicylaldim<strong>in</strong>ato-Ni(II)-Komplexen<br />
40<br />
D<br />
B<br />
20<br />
A<br />
C<br />
E<br />
0<br />
0 10 20 30 40 50 60<br />
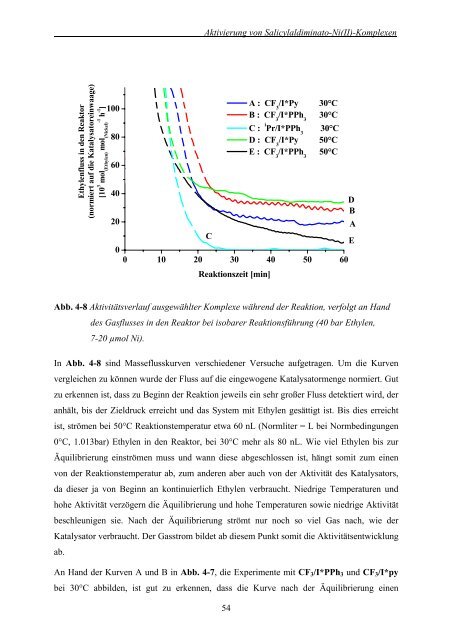
Abb. 4-8 Aktivitätsverlauf ausgewählter Komplexe während der Reaktion, verfolgt an Hand<br />
des Gasflusses <strong>in</strong> den Reaktor bei isobarer Reaktionsführung (40 bar <strong>Ethylen</strong>,<br />
7-20 µmol Ni).<br />
Reaktionszeit [m<strong>in</strong>]<br />
In Abb. 4-8 s<strong>in</strong>d Masseflusskurven verschiedener Versuche aufgetragen. Um die Kurven<br />
vergleichen zu können wurde der Fluss auf die e<strong>in</strong>gewogene Katalysatormenge normiert. Gut<br />
zu erkennen ist, dass zu Beg<strong>in</strong>n der Reaktion jeweils e<strong>in</strong> sehr großer Fluss detektiert wird, der<br />
anhält, bis der Zieldruck erreicht <strong>und</strong> das System <strong>mit</strong> <strong>Ethylen</strong> gesättigt ist. Bis dies erreicht<br />
ist, strömen bei 50°C Reaktionstemperatur etwa 60 nL (Normliter = L bei Normbed<strong>in</strong>gungen<br />
0°C, 1.013bar) <strong>Ethylen</strong> <strong>in</strong> den Reaktor, bei 30°C mehr als 80 nL. Wie viel <strong>Ethylen</strong> bis zur<br />
Äquilibrierung e<strong>in</strong>strömen muss <strong>und</strong> wann diese abgeschlossen ist, hängt so<strong>mit</strong> zum e<strong>in</strong>en<br />
<strong>von</strong> der Reaktionstemperatur ab, zum anderen aber auch <strong>von</strong> der Aktivität des Katalysators,<br />
da dieser ja <strong>von</strong> Beg<strong>in</strong>n an kont<strong>in</strong>uierlich <strong>Ethylen</strong> verbraucht. Niedrige Temperaturen <strong>und</strong><br />
hohe Aktivität verzögern die Äquilibrierung <strong>und</strong> hohe Temperaturen sowie niedrige Aktivität<br />
beschleunigen sie. Nach der Äquilibrierung strömt nur noch so viel Gas nach, wie der<br />
Katalysator verbraucht. Der Gasstrom bildet ab diesem Punkt so<strong>mit</strong> die Aktivitätsentwicklung<br />
ab.<br />
An Hand der Kurven A <strong>und</strong> B <strong>in</strong> Abb. 4-7, die Experimente <strong>mit</strong> CF3/I*PPh3 <strong>und</strong> CF3/I*py<br />
bei 30°C abbilden, ist gut zu erkennen, dass die Kurve nach der Äquilibrierung e<strong>in</strong>en<br />
54<br />
A : CF 3 /I*Py 30°C<br />
B : CF 3 /I*PPh 3 30°C<br />
C : i Pr/I*PPh 3 30°C<br />
D : CF 3 /I*Py 50°C<br />
E : CF 3 /I*PPh 3 50°C