- Seite 1 und 2: Kontrollierte radikalische Polymeri
- Seite 3 und 4: Die vorliegende Arbeit wurde in der
- Seite 5 und 6: Inhaltsverzeichnis ABBILDUNGSVERZEI
- Seite 7 und 8: Abbildungsverzeichnis Abbildung I-1
- Seite 9 und 10: Abbildung IV-28: MALDI-TOF-MS-Aussc
- Seite 11 und 12: Abbildung V-35: Anwendung des „pe
- Seite 13 und 14: Tabelle IV-2: Konzentration der Pol
- Seite 15 und 16: Tabelle V-19: Polymerisationsgeschw
- Seite 17 und 18: Grundlagen der kontrollierten radik
- Seite 19 und 20: Grundlagen der kontrollierten radik
- Seite 21 und 22: Grundlagen der kontrollierten radik
- Seite 23 und 24: Grundlagen der kontrollierten radik
- Seite 25 und 26: Grundlagen der kontrollierten radik
- Seite 27 und 28: Grundlagen der kontrollierten radik
- Seite 29 und 30: Grundlagen der kontrollierten radik
- Seite 31 und 32: Grundlagen der kontrollierten radik
- Seite 33 und 34: Grundlagen der kontrollierten radik
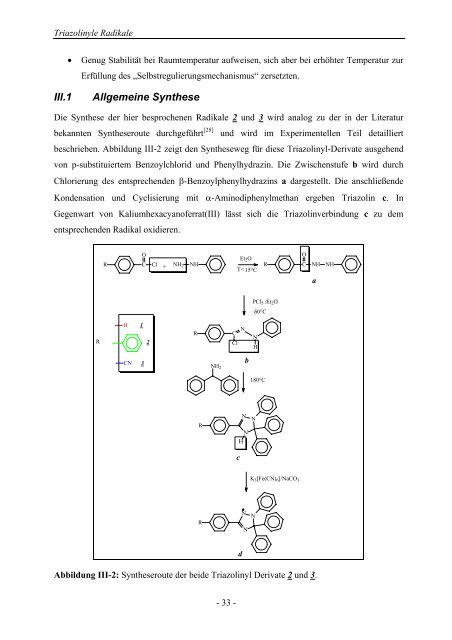
- Seite 35: Triazolinyle Radikale III Die Triaz
- Seite 39 und 40: Triazolinyle Radikale Absorption (a
- Seite 41 und 42: Triazolinyle Radikale ln(k zerf ) (
- Seite 43 und 44: Triazolinyle Radikale III.4 Zusamme
- Seite 45 und 46: Kontrollierte radikalische Polymeri
- Seite 47 und 48: Kontrollierte radikalische Polymeri
- Seite 49 und 50: Kontrollierte radikalische Polymeri
- Seite 51 und 52: Kontrollierte radikalische Polymeri
- Seite 53 und 54: Kontrollierte radikalische Polymeri
- Seite 55 und 56: Kontrollierte radikalische Polymeri
- Seite 57 und 58: Kontrollierte radikalische Polymeri
- Seite 59 und 60: Kontrollierte radikalische Polymeri
- Seite 61 und 62: Kontrollierte radikalische Polymeri
- Seite 63 und 64: Kontrollierte radikalische Polymeri
- Seite 65 und 66: Kontrollierte radikalische Polymeri
- Seite 67 und 68: Kontrollierte radikalische Polymeri
- Seite 69 und 70: Kontrollierte radikalische Polymeri
- Seite 71 und 72: Kontrollierte radikalische Polymeri
- Seite 73 und 74: Kontrollierte radikalische Polymeri
- Seite 75 und 76: Kontrollierte radikalische Polymeri
- Seite 77 und 78: Kontrollierte radikalische Polymeri
- Seite 79 und 80: Kontrollierte radikalische Polymeri
- Seite 81 und 82: Kontrollierte radikalische Polymeri
- Seite 83 und 84: Kontrollierte radikalische Polymeri
- Seite 85 und 86: Kontrollierte radikalische Polymeri
- Seite 87 und 88:
Kontrollierte radikalische Polymeri
- Seite 89 und 90:
Kontrollierte radikalische Polymeri
- Seite 91 und 92:
Kontrollierte radikalische Polymeri
- Seite 93 und 94:
Kontrollierte radikalische Polymeri
- Seite 95 und 96:
Kontrollierte radikalische Polymeri
- Seite 97 und 98:
Kontrollierte radikalische Polymeri
- Seite 99 und 100:
Kontrollierte radikalische Polymeri
- Seite 101 und 102:
Kontrollierte radikalische Polymeri
- Seite 103 und 104:
Kontrollierte radikalische Polymeri
- Seite 105 und 106:
Kontrollierte radikalische Polymeri
- Seite 107 und 108:
Kontrollierte radikalische Polymeri
- Seite 109 und 110:
Kontrollierte radikalische Polymeri
- Seite 111 und 112:
Kontrollierte radikalische Polymeri
- Seite 113 und 114:
Kontrollierte radikalische Polymeri
- Seite 115 und 116:
Kontrollierte radikalische Polymeri
- Seite 117 und 118:
Kontrollierte radikalische Polymeri
- Seite 119 und 120:
Kontrollierte radikalische Polymeri
- Seite 121 und 122:
Kontrollierte radikalische Polymeri
- Seite 123 und 124:
Kontrollierte radikalische Polymeri
- Seite 125 und 126:
Kontrollierte radikalische Polymeri
- Seite 127 und 128:
Kontrollierte radikalische Polymeri
- Seite 129 und 130:
Kontrollierte radikalische Polymeri
- Seite 131 und 132:
Kontrollierte radikalische Polymeri
- Seite 133 und 134:
Kontrollierte radikalische Polymeri
- Seite 135 und 136:
Kontrollierte radikalische Polymeri
- Seite 137 und 138:
Kontrollierte radikalische Polymeri
- Seite 139 und 140:
Kontrollierte radikalische Polymeri
- Seite 141 und 142:
Kontrollierte radikalische Polymeri
- Seite 143 und 144:
Kontrollierte radikalische Polymeri
- Seite 145 und 146:
Kontrollierte radikalische Polymeri
- Seite 147 und 148:
Kontrollierte radikalische Polymeri
- Seite 149 und 150:
Kontrollierte radikalische Polymeri
- Seite 151 und 152:
Kontrollierte radikalische Polymeri
- Seite 153 und 154:
Kontrollierte radikalische Polymeri
- Seite 155 und 156:
Kontrollierte radikalische Polymeri
- Seite 157 und 158:
Kontrollierte radikalische Polymeri
- Seite 159 und 160:
Kontrollierte radikalische Polymeri
- Seite 161 und 162:
Kontrollierte radikalische Polymeri
- Seite 163 und 164:
Kontrollierte radikalische Polymeri
- Seite 165 und 166:
Kontrollierte radikalische Polymeri
- Seite 167 und 168:
Kontrollierte radikalische Polymeri
- Seite 169 und 170:
Kontrollierte radikalische Polymeri
- Seite 171 und 172:
Kontrollierte radikalische Polymeri
- Seite 173 und 174:
Kontrollierte radikalische Polymeri
- Seite 175 und 176:
Kontrollierte radikalische Polymeri
- Seite 177 und 178:
Kontrollierte radikalische Polymeri
- Seite 179 und 180:
Kontrollierte radikalische Polymeri
- Seite 181 und 182:
Kontrollierte radikalische Polymeri
- Seite 183 und 184:
Kontrollierte radikalische Polymeri
- Seite 185 und 186:
Kontrollierte radikalische Polymeri
- Seite 187 und 188:
Kontrollierte radikalische Polymeri
- Seite 189 und 190:
Kontrollierte radikalische Polymeri
- Seite 191 und 192:
Kontrollierte radikalische Polymeri
- Seite 193 und 194:
Vinylacetat und Acrylnitril VI Viny
- Seite 195 und 196:
Vinylacetat und Acrylnitril Nach de
- Seite 197 und 198:
Vinylacetat und Acrylnitril VI.2 Ac
- Seite 199 und 200:
Vinylacetat und Acrylnitril Betrach
- Seite 201 und 202:
Vinylacetat und Acrylnitril Zusamme
- Seite 203 und 204:
Natrium-Styrolsulfonat N Ph Ph R N
- Seite 205 und 206:
Natrium-Styrolsulfonat Tabelle VII-
- Seite 207 und 208:
Zusammenfassung und Ausblick VIII Z
- Seite 209 und 210:
Zusammenfassung und Ausblick zwar d
- Seite 211 und 212:
Zusammenfassung und Ausblick Altern
- Seite 213 und 214:
Experimenteller Teil Nach Abbruch d
- Seite 215 und 216:
Experimenteller Teil so werden im M
- Seite 217 und 218:
Experimenteller Teil Ausbeute: 73%
- Seite 219 und 220:
Experimenteller Teil Produkt abgesa
- Seite 221 und 222:
Experimenteller Teil FD-Massenspekt
- Seite 223 und 224:
Experimenteller Teil Ausbeute: 81%
- Seite 225 und 226:
Experimenteller Teil Elementaranaly
- Seite 227 und 228:
X Bibliographie [1] K. Matyjaszewsk
- Seite 229 und 230:
[39] C. Yoshikawa, A. Goto, T. Fuku
- Seite 231 und 232:
[81] M. Steenbock, M. Klapper, K. M
- Seite 233 und 234:
[126] P. Eibeck, J. P. Spatz, S. Mo
- Seite 235:
[172] W. N. E. van Dijk-Wolthuis, P