Wärmelehre - gilligan-online
Wärmelehre - gilligan-online
Wärmelehre - gilligan-online
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
Mit den Ansätzen<br />
δ Q = nC dT<br />
(stoffmengenbezogen) bzw.<br />
mv<br />
δ Q = mc dT<br />
(massenbezogen)<br />
v<br />
sowie der speziellen Formulierung des 1. Hauptsatzes<br />
d U = δQ<br />
ergeben sich in differentieller Schreibweise als Definitionsgleichungen<br />
• für die isochore molare Wärmekapazität<br />
• für die spezifische isochore Wärmekapazität<br />
C<br />
c<br />
mv =<br />
v =<br />
1 dU<br />
n dT<br />
1 dU<br />
m dT<br />
Der Index ‘v‘ impliziert dabei konstantes Volumen, also unter der experimentellen<br />
Forderung isochor.<br />
p<br />
4.2 Isotherme Zustandsänderungen<br />
Wird in einem geschlossenen System bei einem thermodynamischen Prozess die<br />
Temperatur konstant gehalten, so gilt<br />
T = const. und damit d T = 0<br />
Dies lässt sich experimentell im Versuch dadurch erreichen, dass ein System in sehr<br />
gutem Wärmekontakt mit einem großen Wärmebad gebracht wird. Es findet ein<br />
idealer ungehinderter Wärmeaustausch über die Systemgrenze statt, der<br />
Temperaturkonstanz gewährleistet.<br />
Da für ein ideales Gas in einem geschlossenen System die Innere Energie U allein<br />
von der absoluten Temperatur T abhängt, ist für einen isothermen Vorgang<br />
wegen d T = 0 auch d U = 0 .<br />
Die Innere Energie U ändert sich bei einer isothermen Zustandsänderung nicht.<br />
Wärmeaustausch ist bei isothermen Prozessen mit der Übertragung von Arbeit, also<br />
der Verschiebung der Systemgrenzen gekoppelt. Verrichtete Arbeit über die<br />
Systemgrenze bewirkt Wärmeübertragung.<br />
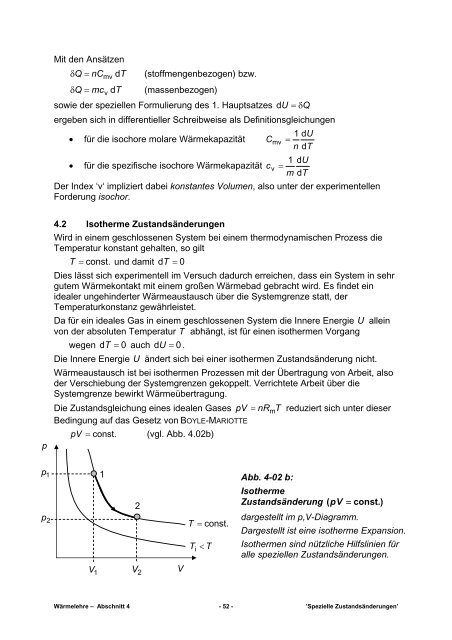
Die Zustandsgleichung eines idealen Gases pV = nRmT<br />
reduziert sich unter dieser<br />
Bedingung auf das Gesetz von BOYLE-MARIOTTE<br />
pV = const. (vgl. Abb. 4.02b)<br />
p 1<br />
p 2<br />
1<br />
2<br />
V 1 V2<br />
V<br />
T<br />
= const.<br />
T < T i<br />
Abb. 4-02 b:<br />
Isotherme<br />
Zustandsänderung ( pV = const.)<br />
dargestellt im p,V-Diagramm.<br />
Dargestellt ist eine isotherme Expansion.<br />
Isothermen sind nützliche Hilfslinien für<br />
alle speziellen Zustandsänderungen.<br />
<strong>Wärmelehre</strong> – Abschnitt 4<br />
- 52 -<br />
’Spezielle Zustandsänderungen’















![[1.5pt] Wellenlehre[8.5pt] Zusammenfassung - gilligan-online](https://img.yumpu.com/21507627/1/184x260/15pt-wellenlehre85pt-zusammenfassung-gilligan-online.jpg?quality=85)