- Page 2 and 3: 1 BUKU TEKS KIMIA ANORGANIK ONLINE
- Page 4 and 5: Pengantar Penerjemah Untuk mengatas
- Page 6 and 7: alata analitis yang lain. Kini menj
- Page 8 and 9: a Bilangan oksidasi ...............
- Page 10 and 11: 1 Unsur dan Periodisitas Unsur-unsu
- Page 12 and 13: elektron didefinisikan dengan empat
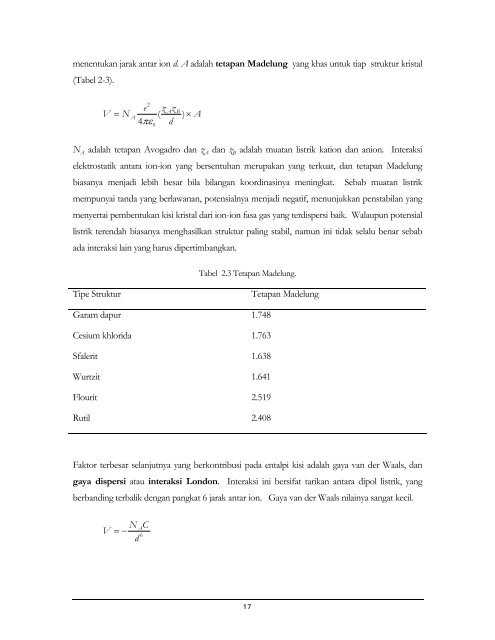
- Page 14 and 15: Tabel 1.1 Sistem periodik unsur, an
- Page 16 and 17: Gambar 1.2 Klasifikasi unsur dalam
- Page 18 and 19: terbentuk antara unsur yang keelekt
- Page 20 and 21: 2 Ikatan dan Struktur Jari-jari ato
- Page 22 and 23: sifat kimia senyawa yang diketahui,
- Page 24 and 25: kita dapat mengkompilasi jari-jari
- Page 28 and 29: Gambar 2.3 Susunan ccp bola. Bila k
- Page 30 and 31: Kisi dengan bola lain di pusat kisi
- Page 32 and 33: Gambar 2.7 Struktur NaCl. Cesium kh
- Page 34 and 35: [Jawab] empat kation ada di dalam s
- Page 36 and 37: susunan terjejal anion. Gambar 2.12
- Page 38 and 39: Unsur-unsur gas mulia memiliki stru
- Page 40 and 41: Tabel 2.6 Ke-elektronegativan Pauli
- Page 42 and 43: Walaupun definisi Mulliken jelas se
- Page 44 and 45: Gambar 2.15 Pembentukan orbital mol
- Page 46 and 47: Gambar 2.18 Orbital molekul H 2 . T
- Page 48 and 49: Orbital molekul dua atom yang berbe
- Page 50 and 51: Teori besar dan evaluasi Teori elek
- Page 52 and 53: Proses yang secara termodinamika ir
- Page 54 and 55: Zn +2 (aq) + 2 e - → Zn(s) ∆G 0
- Page 56 and 57: molibdenum adalah reduktor dan beru
- Page 58 and 59: Oleh karena itu, mengurutkan kekuat
- Page 60 and 61: memberikan H + ke air, membentuk H
- Page 62 and 63: logam diklasifikasikan dalam urutan
- Page 64 and 65: 4 Kimia Unsur Non-Logam Ada sekitar
- Page 66 and 67: Litium hidrida, LiH, senyawa krista
- Page 68 and 69: yang menunjukkan sifat hantaran log
- Page 70 and 71: Teori baru diusulkan untuk menjelas
- Page 72 and 73: Tidak hanya diboran, boran yang leb
- Page 74 and 75: Fuleren adalah nama generik untuk a
- Page 76 and 77:
Fosfor putih adalah molekul dengan
- Page 78 and 79:
4.3 Oksigen dan oksida a Oksigen Di
- Page 80 and 81:
menggunakan reaksi katalitik sangat
- Page 82 and 83:
Aluminosilikat Terdapat banyak mine
- Page 84 and 85:
Tabel 4.4 Berbagai oksida khas unsu
- Page 86 and 87:
Dengan oksidasi satu elektron, NO 2
- Page 88 and 89:
Oksida dengan komposisi di antara f
- Page 90 and 91:
semikonduktor, konduktor bahkan sup
- Page 92 and 93:
Gambar 4.12 Struktur Cs 11 O 3 Oksi
- Page 94 and 95:
Mangan dioksida, MnO 2 , cenderung
- Page 96 and 97:
Gambar 4.15 Struktur spinel. Perovs
- Page 98 and 99:
Gambar 4.17 Struktur Keggin. Anion
- Page 100 and 101:
Gambar 4.18 Struktur S 5 2-, S 8 ,
- Page 102 and 103:
(M = Pb, Sn, dan Cu; X = S, Se, dan
- Page 104 and 105:
yang panjang sebelum unsur flourin
- Page 106 and 107:
Tabel 4.8 Khlorida dan flourida kha
- Page 108 and 109:
Tabel 4.9 Fluorida dan Khlorida kha
- Page 110 and 111:
Paladium khlorida, PdCl 2 adalah pa
- Page 112 and 113:
Cesium khlorida, CsCl. Padatan kris
- Page 114 and 115:
xenon membentuk senyawa dengan vale
- Page 116 and 117:
5 Kimia Logam Golongan Utama Logam
- Page 118 and 119:
ditangani dengan cukup mudah. Logam
- Page 120 and 121:
digunakan sebagai sumber partikel
- Page 122 and 123:
Senyawa organo-aluminum Senyawa-sen
- Page 124 and 125:
an saat industri petrokimia memulai
- Page 126 and 127:
Cr(III). Ion akua (ion dengan ligan
- Page 128 and 129:
koordinasi 4 sampai 6 adalah yang p
- Page 130 and 131:
Gambar 6.2 Pseudorotasi Berry. Komp
- Page 132 and 133:
6.2 Struktur electronik kompleks Di
- Page 134 and 135:
Gambar 6.6 Pembelahan medan ligan d
- Page 136 and 137:
Gambar 6.7 Perubahan energi orbital
- Page 138 and 139:
di orbital yang lebih atas, sistemn
- Page 140 and 141:
Gambar 6.10 Orbital molekul ikatan
- Page 142 and 143:
Gambar 6.12 Perubahan energi akibat
- Page 144 and 145:
Gambar 6.13 Spektrum absorpsi visib
- Page 146 and 147:
magnet. Selain metoda ini, metoda y
- Page 148 and 149:
pada atom besi. Walaupun berbagai m
- Page 150 and 151:
menutupi tiga logam) berkoordinasi
- Page 152 and 153:
Tabel 6.5 Haptisitas dan jumlah ele
- Page 154 and 155:
Gambar 6.16 Struktur ferosen. Anali
- Page 156 and 157:
Kompleks arena Senyawa aromatik ada
- Page 158 and 159:
Tabel 6.7 Kompleks fosfin tersier (
- Page 160 and 161:
Gambar 6.19 Struktur [CoH(N 2 )(PPh
- Page 162 and 163:
Konsep ikatan tunggal antar logam y
- Page 164 and 165:
Gambar 6.22 Tumpang tindih orbital
- Page 166 and 167:
Kompleks kluster logam dapat secara
- Page 168 and 169:
Gambar 6.25 Struktur [Fe 4 S 4 (SR)
- Page 170 and 171:
Kestabilan termodinamika produk sub
- Page 172 and 173:
medan ligan. Oleh karena itu, laju
- Page 174 and 175:
6.4 Usulkan cara sintesis selektif
- Page 176 and 177:
Tabel 7.1 Sifat-sifat lantanoid Kar
- Page 178 and 179:
T ln 2 0.693 = = λ λ Latihan 7.2
- Page 180 and 181:
8 Reaksi dan Sifat-sifat Fisik Bida
- Page 182 and 183:
Reaksi sisipan Dalam reaksi suatu l
- Page 184 and 185:
8.2 Bioanorganik Banyak reaksi biol
- Page 186 and 187:
Fiksasi nitrogen Reaksi yang mengub
- Page 188 and 189:
eduksi Mn(IV) menjadi Mn (II) dalam
- Page 190 and 191:
Gambar 8.4 Struktur YBa 2 Cu 3 O 7-
- Page 192 and 193:
Kemagnetan Bahan magnetik dibagi at
- Page 194 and 195:
Solusi 1.1 2.1 2.2 Dalam ikatan σ,
- Page 196 and 197:
5.1 2 Li + C 4 H 9 Br ➝ LiC 4 H 9
- Page 198 and 199:
Proses Haber-Bosch menggunakan kata
- Page 200 and 201:
Indeks 2-pusat 2-elektron .........
- Page 202:
struktur Lewis ....................