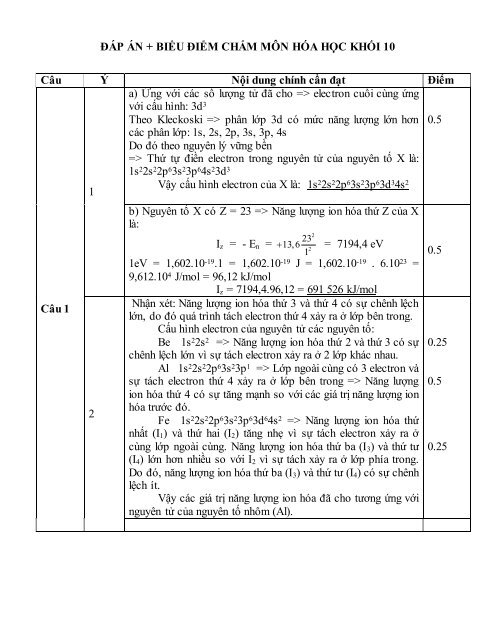
- Page 1 and 2:
HỘI CÁC TRƯỜNG CHUYÊN VÙNG
- Page 3 and 4:
) Tìm pH thích hợp để tách
- Page 6 and 7:
HỘI CÁC TRƯỜNG CHUYÊN VÙNG
- Page 8 and 9:
2. Chuẩn độ 20,00 ml dung dị
- Page 10 and 11:
TRƯỜNG THPT CHUYÊN BẮC GIANG
- Page 12 and 13:
d) A = A1 + A2 + ...> A01 0,25 Câu
- Page 14 and 15: 2. Ag + Fe 3+ Ag + + Fe 2+ CMcb 0,0
- Page 16 and 17: 11
- Page 18 and 19: 2. Các nuclit phóng xạ nhân t
- Page 20 and 21: 2. Nêu và giải thích ngắn g
- Page 22 and 23: *C + : E ( I2 I3 I4 I5 I6)
- Page 24 and 25: 2 2 x 2 2x Ta có: 1,85 1 x
- Page 26 and 27: CÂU 7 1/ Ta có các cân bằng:
- Page 28 and 29: 1 16 K6 x.(0,03 x) 10 x = 3,33
- Page 30 and 31: Như thế, phản ứng có sự p
- Page 32 and 33: Câu 5 (2đ): Cân bằng hóa họ
- Page 34 and 35: ĐÁP ÁN VÀ BIỂU ĐIỂM ĐỀ
- Page 36 and 37: % = 1,5109 100% 32,8585% 4,5982 0.
- Page 38 and 39: 0,3302 atm 2 . d. Do P (toàn phầ
- Page 40 and 41: Hướng dẫn: Nội dung 0 0 0 0
- Page 42 and 43: n O ban đầu = 1,5. x 11y 2 4 n =
- Page 44 and 45: HỘI CÁC TRƯỜNG CHUYÊN VÙNG
- Page 46 and 47: Câu 7 (2 điểm) (a) Hòa tan ho
- Page 48 and 49: |TRƯỜNG ĐẠI HỌC SƯ PHẠM
- Page 50 and 51: 1. Lập sơ đồ tách các catio
- Page 52 and 53: 10 (3,7.10 nt.s N 11 (1,38.10 s 1
- Page 54 and 55: Câu 6: (2 điểm) CB axit, bazơ,
- Page 56 and 57: Ý Nội dung Điểm anot: CH 3 OH
- Page 58 and 59: Gọi x, y là số mol FeS và Fe
- Page 60 and 61: HỘI CÁC TRƯỜNG CHUYÊN VÙNG
- Page 62 and 63: 4) Tính K P của phản ứng kh
- Page 66 and 67: •) Xét tại t =12 giờ: Ta bi
- Page 68 and 69: Áp dụng định luật bảo to
- Page 70 and 71: Câu 9 2. Vì thế, nước có nh
- Page 72 and 73: TRƯỜNG THPT CHUYÊN NGUYỄN TR
- Page 74 and 75: sáng sẽ bị rửa bằng cách
- Page 76 and 77: - NO 2 có góc liên kết lớn n
- Page 78 and 79: Tính chất nhiệt động của
- Page 80 and 81: gần đúng theo một cân bằng
- Page 82 and 83: phương trình hoá học giải t
- Page 84 and 85: 1 1 - = kt a-x a Từ các dữ ki
- Page 86: Câu 6. (2 điểm) Cân bằng tro
- Page 89 and 90: sp của nguyên tử C, có năng
- Page 91 and 92: Để kết tủa Fe(OH)3 thì [OH
- Page 93 and 94: 10 b) c) phản ứng: 4Fe(OH)2 + O
- Page 95 and 96: HỘI CÁC TRƯỜNG CHUYÊN VÙNG
- Page 97 and 98: NH 4 COONH 2 (r) CO 2 (k) NH 3 (k)
- Page 99 and 100: 0 0,1079 0,0021 Xét cân bằng Mg
- Page 101 and 102: Câu 9 (2 điểm) Những thay đ
- Page 103 and 104: SỞ GIÁO DỤC VÀ ĐÀO TẠO H
- Page 105 and 106: n CO 2x + y => y = 0,41 mol n 1,0
- Page 107 and 108: m => Vdd HCl = ddHCl 1.36,5.100% =
- Page 109 and 110: Trong mạng tinh thể của Beri
- Page 111 and 112: STT Phản ứng H 0 298 (kj) 1 2N
- Page 113 and 114: Cho T Mg(OH) 2 = 10 -11 ; T Fe(OH)
- Page 115 and 116:
2KI + KNO3+H2SO4 I2 + KNO2+H2O 3I2
- Page 117 and 118:
SỞ GIÁO DỤC VÀ ĐÀO TẠO H
- Page 119 and 120:
3 Phản ứng hạt nhân 1. a) 6C
- Page 121 and 122:
CH3COOH CH3COO - + H + Ka = 10 -4,7
- Page 123 and 124:
8 8- Nhóm halogen H 1. Cl2 + 2NaBr
- Page 125 and 126:
2.BBr3 + PBr3 +3H2 → BP + 6HBr T
- Page 127 and 128:
Câu 2 a) C [He]2s 2 2p 2 C * [He]2
- Page 129 and 130:
) Theo đề, ΔH và S của chấ
- Page 131 and 132:
3 Vậy PO 4 tự do [H + ] khôn
- Page 133 and 134:
0, 45 11 + Nếu A cháy hoàn toà
- Page 135 and 136:
SỞ GIÁO DỤC VÀ ĐÀO TẠO TT
- Page 137 and 138:
2. Nếu O3 có cấu tạo vòng 3
- Page 139 and 140:
2 2 Áp dụng định luật tác
- Page 141 and 142:
1. Phương trình phản ứng: S
- Page 143 and 144:
Trong dung dịch có các cân b
- Page 145 and 146:
3 12,4 .4,133 -8 Q= =461,317>K 2 p(
- Page 147 and 148:
2 A là KI; B HIO3; C: I2O5; D: KIO
- Page 149 and 150:
HỘI CÁC TRƯỜNG CHUYÊN VÙNG
- Page 151 and 152:
1. Tại sao HF có khả năng t
- Page 153 and 154:
2. Cho phản ứng: CO2 (khí) CO
- Page 155 and 156:
2.BP (bo photphua) là một chất
- Page 157 and 158:
. Phân rã kế tiếp của 238 U
- Page 159 and 160:
Chất X ở dạng tinh thể màu
- Page 161 and 162:
TeCl 4 sp 3 d tháp vuông BrF 3 sp
- Page 163 and 164:
- Công phi thể tích = 0 *Quá t
- Page 165 and 166:
0,204 (2,449) (7,347) K p = 1/ 2 3/
- Page 167 and 168:
C 0,1 [ ] 0,1 - x 2x [HCrO ] (2x) K
- Page 169 and 170:
Theo (4) Số mol IO x = x 1 (s
- Page 171 and 172:
HỘI CÁC TRƯỜNG CHUYÊN VÙNG
- Page 173 and 174:
) Các kết quả thu được ở
- Page 175 and 176:
(NH 3 ) = - 45,9 kJ mol -1 ; ΔH t
- Page 177 and 178:
H 2 PO - 4 + OH - → HPO 2- 4 + H
- Page 179 and 180:
6 c Áp suất ban đầu: P P 0 Ph
- Page 181 and 182:
7 a b đoán sự hòa tan phức l
- Page 183 and 184:
=> lgv pư = lgk pư + nlg[S 2 O 8
- Page 185 and 186:
Câu IV (2,0 điểm) Nhiệt hóa
- Page 187 and 188:
Câu IX (2,0 điểm). Oxi-lưu hu
- Page 189 and 190:
Câu Nội dung chính cần đạt
- Page 191 and 192:
Câu Nội dung chính cần đạt
- Page 193 and 194:
HỘI CÁC TRƯỜNG CHUYÊN VÙNG
- Page 195 and 196:
T: Nhiệt độ (K) bất kỳ; (g
- Page 197 and 198:
Câu hỏi Câu 1 Câu 2 ĐÁP ÁN
- Page 199 and 200:
Câu 3 3.1. Ta có: E = m.C 2 m
- Page 201 and 202:
Câu 6 6.1. 0 c) Dựa vào biểu
- Page 203 and 204:
0,1 5.10 0,059lg = 0,463V 7 * Xét
- Page 205 and 206:
0,8 0,5 0,4 0,1 0,4 (mol) Sản ph
- Page 207 and 208:
HỘI CÁC TRƯỜNG CHUYÊN VÙNG
- Page 209 and 210:
Câu 7: (2,0 điểm) Phản ứng
- Page 211 and 212:
HÓA HỌC 10-DUYEN HẢI 2015 SỞ
- Page 213 and 214:
HÓA HỌC 10-DUYEN HẢI 2015 Câu
- Page 215 and 216:
CaCO3 (r) ⇌ CaO (r) + CO2 (k) K1
- Page 217 and 218:
Trong một tinh thể, sự sắp
- Page 219 and 220:
6c. + Về nguyên tắc quan niệ
- Page 221 and 222:
10c. Năng lượng hoạt hóa E
- Page 223 and 224:
3. Một phần tử trong chuỗi
- Page 225 and 226:
D+ A dd KOH,t 0 A KNO dd KOH 3, H 2
- Page 227 and 228:
Xét chuỗi phân hủy phóng x
- Page 229 and 230:
SỞ GD VÀ ĐT VĨNH PHÚC HDC Đ
- Page 231 and 232:
4 a) G o =H o - TS o H o = 2H o s (
- Page 233 and 234:
[ ] y 0,03 + 2y Theo cân bằng (5
- Page 235 and 236:
HỘI CÁC TRƯỜNG CHUYÊN ĐỀ
- Page 237 and 238:
Ksp(Ag3PO4) = 10 - 19,9 Câu 7( 2
- Page 239 and 240:
ĐÁP ÁN + BIỂU ĐIỂM CHẤM M
- Page 241 and 242:
m 2 = 1000 - m 1 = 1000 - 18,85 hay
- Page 243 and 244:
0,2 0,4 ( atm) Vừa mới trộn:
- Page 245 and 246:
lg K’ = lgK + 3lg 4 = -15,3 + 3.
- Page 247 and 248:
x mol X x mol XSO 4 y mol Y y/2 m
- Page 249 and 250:
HỘI CÁC TRƯỜNG CHUYÊN VÙNG
- Page 251 and 252:
a) Vẽ cấu trúc cho các hợp
- Page 253 and 254:
(2,0 điểm) HX - + H2O ƒ H2X + O
- Page 255 and 256:
Câu 4 (2,0 điểm) 1 2 Phản ứ
- Page 257 and 258:
Cl 2 OH - H 3 O + O O O c/ OH - OH
- Page 259 and 260:
nNaOH (1), (2)= 0,7 - 0,2 = 0,5 mol
- Page 261 and 262:
SỞ GIÁO DỤC VÀ ĐÀO TẠO B
- Page 263 and 264:
Trong dung dịch nước, A phản
- Page 265 and 266:
Câu 7 (Nhận biết, Tách chất
- Page 267 and 268:
0 H T KJ.mol -1 -374,5 - 287,0 0 0
- Page 269 and 270:
Gọi số mol xiclobutan ban đầ
- Page 271 and 272:
[Cr 3+ ] + [CrOH 2+ ] = 10 -6 M →
- Page 273 and 274:
Áp dụng pt Nernst ta có: 0,0592
- Page 275 and 276:
Vậy không thể tách riêng hai
- Page 277 and 278:
2.(0,5 điểm) Styryllacton đư
- Page 279 and 280:
2. Tên: 8-hiđroxi-7-phenyl-2,6-đ
- Page 281 and 282:
Hướng dẫn chấm: 1.(1 điểm
- Page 283 and 284:
Câu 3:( Nhận biết, Tách chấ
- Page 285 and 286:
Vậy công thức của M là: HO
- Page 287 and 288:
3. Cấu tạo của hợp chất K
- Page 289 and 290:
Câu 9: Cho phản ứng PCl 5 (k)
- Page 291 and 292:
2.Cho các ion phức : [NiSe 4 ] 2
- Page 293 and 294:
HỘI CÁC TRƯỜNG CHUYÊN VÙNG
- Page 295 and 296:
Câu 5.Sơ đồ biến hóa, Cơ c
- Page 297 and 298:
là sắt). Khi để ra ngoài kh
- Page 299 and 300:
.E a của phản ứng thuận âm
- Page 301 and 302:
Từ đó cho biết vai trò của
- Page 303 and 304:
muối thu được là PbSO 4 (mu
- Page 305 and 306:
Dẫn xuất o-amino của axit ben
- Page 307 and 308:
hh loûng (X) + HCl ete C 6 H 5 NH(
- Page 309 and 310:
a. Tính K p của phản ứng (1)
- Page 311 and 312:
Vậy : A là K 4 [Fe(CN) 6 ] Anion
- Page 313 and 314:
Câu 5 (2,0đ): Sơ đồ biến h
- Page 315 and 316:
SỞ GIÁO DỤC VÀ ĐÀO TẠO Đ
- Page 317 and 318:
Câu 3 (2,0đ): N Ag = 0,100 : 107,
- Page 319 and 320:
Cl NH 3 Pt Cl NH 3 cis H 3 N Cl Pt
- Page 321 and 322:
Li + CH 3 -CH 2 -CHO H 2N-C(CH 3 )
- Page 323 and 324:
HỘI CÁC TRƯỜNG THPT CHUYÊN V
- Page 325 and 326:
COOCH 2 CH 3 được tổng hợp
- Page 327 and 328:
d. Viết phương trình phản
- Page 329 and 330:
Thay (7) vào (4) ta có: [N 2 O] =
- Page 331 and 332:
Vậy sau khi phản ứng với NH
- Page 333 and 334:
Ta có: Br - trước, Cl - sau. E
- Page 335 and 336:
1 0, 06 [Fe 3+ ] = [Fe 3+ ] ’ . =
- Page 337 and 338:
Hiđro nội phân tử làm giảm
- Page 339 and 340:
0,8.n B 2 [C3H 8] = = 0,8.0,104 = 8
- Page 341 and 342:
H 3 N H 3 N CN Co CN NH 3 CN H 3 N
- Page 343 and 344:
Câu 5: 5.1. Gọi tên IUPAC kèm
- Page 345 and 346:
ĐÁP ÁN Câu 1. (2 điểm) Cho p
- Page 347 and 348:
Câu 3. (2 điểm) Có thể hòa
- Page 349 and 350:
3. Viết cơ chế phản ứng sa
- Page 351 and 352:
. Trong phòng thí nghiệm có 4
- Page 353 and 354:
(C) Triclorotrixianocobantat(III).
- Page 355 and 356:
Sau một thời gian khá dài, á
- Page 357 and 358:
Hình 1. Cấu tạo khái quát c
- Page 359 and 360:
K =[Ag ][Br ]= S 1 [NH ]+ [NH ] 2 +
- Page 361 and 362:
Et3 N;100 4) 2NaBH4 + 5B2H6 180
- Page 363 and 364:
0,5 đ Câu 5. (4,0 đ) 1. Phươn
- Page 365 and 366:
n(IO3 ) = 0,7 mmol IO3 + 6H + + 6
- Page 367 and 368:
d CH 3 dt = k1[CH4] - k2[CH4].[CH3
- Page 369 and 370:
Bài 3. (2 điểm): Điện hóa h
- Page 371 and 372:
Hướng dẫn giải 1. (1.0 đi
- Page 373 and 374:
OH H - - - O O C CH 3 OH + A COCH 3
- Page 375 and 376:
Cho sulcatol tác dụng với ozon
- Page 377 and 378:
chuyển sang trạng thái sp 2 ph
- Page 379 and 380:
2. (1 điểm) Coban tạo ra đư
- Page 381 and 382:
HỘI CÁC TRƯỜNG CHUYÊN VÙNG
- Page 383 and 384:
[A - ] + [B - ] = [H + ] (Eq. 2)
- Page 385 and 386:
NH3 + H + + NH 4 H3AsO4 + NH3 -
- Page 387 and 388:
2. Viết cơ chế của chuyển
- Page 389 and 390:
2. Xác định cấu tạo các ch
- Page 391 and 392:
HCl(k) -46,2 -16,6 2. Giả thiết
- Page 393 and 394:
TRƯỜNG THPT CHUYÊN LÊ HỒNG P
- Page 395 and 396:
Tích số tan của Fe(OH) 3 K s =
- Page 397 and 398:
C 3+ Fe [Fe ] 3+ 1 + [C O ] + [C
- Page 399 and 400:
Phản ứng chung: 2Ag + Hg 2 Cl 2
- Page 401 and 402:
4CN - + 2Cu 2+ → 2CuCN + (CN) 2 C
- Page 403 and 404:
.Số đồng phân cấu hình có
- Page 405 and 406:
a. b. c.Naphtalen là hệ liên h
- Page 407 and 408:
Để chuyển hóa 1 mol C thành
- Page 409 and 410:
quinolin có mặt Cu để thực
- Page 411 and 412:
Bài 9: Cân bằng hóa học: Cho
- Page 413 and 414:
Làm hoàn chỉnh ý 2 được 0,
- Page 415 and 416:
[ H ][ F [ HF] Ka (1) => 2[Ca 2+ ]
- Page 417 and 418:
2. Đề nghị cơ chế phản
- Page 419 and 420:
A: HO O B: O O O HO O OH 0,4x5= 2
- Page 421 and 422:
3. Mỗi công thức cho( +1/4 ) x
- Page 423 and 424:
e. Với p(H2S) = 5.1.10 -9 bar th
- Page 425 and 426:
ĐÁP ÁN + BIỂU ĐIỂM CHẤM M
- Page 427 and 428:
0,83 10 [C5H5N] . 0,83 10 1 C 2
- Page 429 and 430:
5 5.1 1 5.2 - Viết cơ chế cho
- Page 431 and 432:
O N N N S 1 O A ONa N N N S O B O O
- Page 433 and 434:
8.2 Cl OH OH O 1 0 +Cl 2 1) NaOH ñ
- Page 435 and 436:
SỞ GIÁO DỤC VÀ ĐÀO TẠO TT
- Page 437 and 438:
2. Nếu O3 có cấu tạo vòng 3
- Page 439 and 440:
2 2 Áp dụng định luật tác
- Page 441 and 442:
1. Phương trình phản ứng: S
- Page 443 and 444:
Câu 2 Nội dung Điểm 1 Tính l
- Page 445 and 446:
Câu 4. (2,0 điểm) Bài tập t
- Page 447 and 448:
Trình bày cơ chế phản ứng
- Page 449 and 450:
Dùng công thức cấu tạo, vi
- Page 451 and 452:
1. Xét cân bằng: CO(k) + 2H2 (k
- Page 453 and 454:
SỞ GÁO DỤC VÀ ĐÀO TẠO HÒ
- Page 455 and 456:
a. Hoàn thành sơ đồ dãy ph
- Page 457 and 458:
3. Tính năng lượng Gibbs tiêu
- Page 459 and 460:
Có một hỗn hợp gồm MgCl2,
- Page 461 and 462:
SỞ GIÁO DỤC-ĐÀO TẠO HƯNG
- Page 463 and 464:
- Tính thế của cực platin nh
- Page 465 and 466:
B OH 1. 2. BF 3 NaOH CH 3 COCl AlCl
- Page 467 and 468:
Sản phẩm khác: b. - Nhiệt đ
- Page 469 and 470:
Số mol khí H2 thu được là:
- Page 471 and 472:
Cl Cl H 3 N H 3 N Co NH 3 NH 3 H 3
- Page 473 and 474:
2. Tính sức điện động củ
- Page 475 and 476:
TRƯỜNG THPT CHUYÊN LÊ HỒNG P
- Page 477 and 478:
a. b. 2.Cho sơ đồ phản ứng
- Page 479 and 480:
Oxi hóa C (C 8 H 12 O 6 ) bằng C
- Page 481 and 482:
trong A ở trạng thái lai hóa
- Page 483 and 484:
Cho pK a (H 2 CO 3 ) = 6,35; 10,33;
- Page 485 and 486:
Câu 8 (2,0 điểm): Hữu cơ t
- Page 487 and 488:
HỘI CÁC TRƯỜNG CHUYÊN VÙNG
- Page 489 and 490:
Ca 2+ + CO 2 CaCO 3 3 C (M) 8.10 -
- Page 491 and 492:
C o 0,05 0,05 TPGH AgBr, Br 2 0,05M
- Page 493 and 494:
A là một ancol vì bị đehiđr
- Page 495 and 496:
= - 114420 - 298 (-128,63) = - 7608
- Page 497 and 498:
TRƯỜ NG THP T CHU Y ÊN HÙN G V
- Page 499 and 500:
4. Dung dịch tinh bột với dun
- Page 501 and 502:
Câu 3. (2 điểm) Điện hóa h
- Page 503 and 504:
Câu 9. (2 điểm) Cân bằng hó
- Page 505 and 506:
- Nếu dung dịch chuẩn độ l
- Page 507 and 508:
x(0,030 + x) = 10 -12 12 10 11 Ag
- Page 509 and 510:
Câu 6 1. Ta có giá trị Ka củ
- Page 511 and 512:
Câu 8 Câu 9. 1. nH2O = 0,52 mol v
- Page 513 and 514:
HỘI CÁC TRƯỜNG CHUYÊN VÙNG
- Page 515 and 516:
6.1. Metyl da cam là chất chỉ
- Page 517 and 518:
HÓA HỌC 10-DUYEN HẢI 2015 SỞ
- Page 519 and 520:
HÓA HỌC 10-DUYEN HẢI 2015 Câu
- Page 521 and 522:
d. Phản ứng xảy ra trong 24 g
- Page 523 and 524:
Câu 9: Cân bằng hoá học: (2
- Page 525 and 526:
Từ (**) và (***) [Fe 3+ ] + 3 -
- Page 527 and 528:
C Br HO HO Br HO Br OH Br E D OH O
- Page 529 and 530:
Câu 8: Hữu cơ tổng hợp: Tr
- Page 531 and 532:
2 2 4 x .(4 2 x) 1,92 với P = 10
- Page 533 and 534:
BỘ GIÁO DỤC VÀ ĐÀO TẠO TR
- Page 535 and 536:
Câu 8: (2 điểm) Hữu cơ tổn
- Page 537 and 538:
Cho m gam hợp chất X ( được
- Page 539 and 540:
TRƯỜNG THPT CHUYÊN VĨNH PHÚC
- Page 541 and 542:
Câu 4. Câu 4 (2 điểm) nA 20,16
- Page 543 and 544:
(A) CHO 1. I 2 /NaOH 2. H + COOH (B
- Page 545:
Câu 5 (2 đ) 1. Giản đồ các
- Page 548 and 549:
O2(k) + 2 H2O (l) + 4e → 4OH - (a
- Page 550 and 551:
Câu 1(2 điểm). Tốc độ ph
- Page 552 and 553:
x.(0,005 x) = 10 -1,25 x = 0,0178
- Page 554 and 555:
Có các phương trình phản
- Page 556 and 557:
CH 3 Ph C O (B) CH 3 1.PhMgBr 2.H 2
- Page 558 and 559:
Điều chế CH3CH2CH2OCH2CH2OH 0,
- Page 560 and 561:
CaCO3 (r) ⇌ CaO (r) + CO2 (k) K1