- Page 1 and 2: UNIVERSIDAD COMPLUTENSE DE MADRID F
- Page 3 and 4: UNIVERSIDAD COMPLUTENSE DE MADRID F
- Page 5 and 6: El detalle íntimo y preciso sirve
- Page 7 and 8: También a la gente de Oviedo: Mano
- Page 9 and 10: -4- Formación a escala molecular d
- Page 11 and 12: -1- INTRODUCCIÓN, OBJETIVOS Y ESTR
- Page 13 and 14: Introducción, objetivos y estructu
- Page 15 and 16: Crecimiento Producto A- +B + +C + A
- Page 17 and 18: Introducción, objetivos y estructu
- Page 19 and 20: Introducción, objetivos y estructu
- Page 21 and 22: Introducción, objetivos y estructu
- Page 23 and 24: Termodinámica de los sistemas solu
- Page 25 and 26: Termodinámica de los sistemas solu
- Page 27 and 28: Termodinámica de los sistemas solu
- Page 29 and 30: Termodinámica de los sistemas solu
- Page 31: Termodinámica de los sistemas solu
- Page 35 and 36: Termodinámica de los sistemas solu
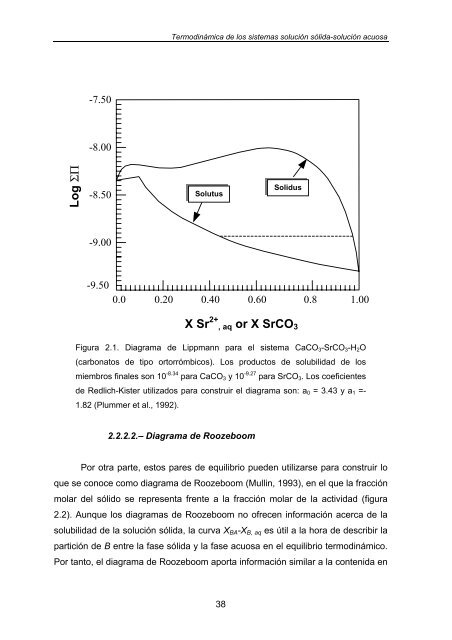
- Page 37 and 38: Termodinámica de los sistemas solu
- Page 39 and 40: Termodinámica de los sistemas solu
- Page 41 and 42: Termodinámica de los sistemas solu
- Page 43 and 44: Termodinámica de los sistemas solu
- Page 45 and 46: -3- COMPORTAMIENTO DE EQUILIBRIO EN
- Page 47 and 48: Comportamiento de equilibrio en los
- Page 49 and 50: Comportamiento de equilibrio en los
- Page 51 and 52: Comportamiento de equilibrio en los
- Page 53 and 54: Comportamiento de equilibrio en los
- Page 55 and 56: Comportamiento de equilibrio en los
- Page 57 and 58: Comportamiento de equilibrio en los
- Page 59 and 60: Comportamiento de equilibrio en los
- Page 61 and 62: Comportamiento de equilibrio en los
- Page 63 and 64: -4- FORMACIÓN A ESCALA MOLECULAR D
- Page 65 and 66: Formación a escala molecular de so
- Page 67 and 68: Formación a escala molecular de so
- Page 69 and 70: Formación a escala molecular de so
- Page 71 and 72: Formación a escala molecular de so
- Page 73 and 74: Tabla 4.II. Modos de operación de
- Page 75 and 76: 4.1.3.- Aplicación del AFM a la mi
- Page 77 and 78: Formación a escala molecular de so
- Page 79 and 80: Formación a escala molecular de so
- Page 81 and 82: Formación a escala molecular de so
- Page 83 and 84:
2µm 2µm a c Formación a escala m
- Page 85 and 86:
Formación a escala molecular de so
- Page 87 and 88:
Formación a escala molecular de so
- Page 89 and 90:
4.2.3.- Sistema (Ba,Ca)CO3-H2O 4.2.
- Page 91 and 92:
H + OH - Iones libres y pares ionic
- Page 93 and 94:
3µm 1µm c a Formación a escala m
- Page 95 and 96:
3µm a Formación a escala molecula
- Page 97 and 98:
Formación a escala molecular de so
- Page 99 and 100:
Solución 3 Formación a escala mol
- Page 101 and 102:
1 µm a Formación a escala molecul
- Page 103 and 104:
4.2.4.- Sistema (Sr,Ca)CO3-H2O 4.2.
- Page 105 and 106:
Iones libres y pares H + OH - Ca 2+
- Page 107 and 108:
4.2.4.2.- Resultados Solución 1 Fo
- Page 109 and 110:
3µm g Formación a escala molecula
- Page 111 and 112:
3µm a 3µm c Formación a escala m
- Page 113 and 114:
Solución 2 Formación a escala mol
- Page 115 and 116:
3µm i Figura 4.25. Continuación F
- Page 117 and 118:
Solución 3 Formación a escala mol
- Page 119 and 120:
5 µm i Formación a escala molecul
- Page 121 and 122:
5 µm a Formación a escala molecul
- Page 123 and 124:
Formación a escala molecular de so
- Page 125 and 126:
Formación a escala molecular de so
- Page 127 and 128:
4.2.5.- Sistema (Mn,Ca)CO3-H2O 4.2.
- Page 129 and 130:
Formación a escala molecular de so
- Page 131 and 132:
3µm (2) a (3) (1) 3µm c (4) Forma
- Page 133 and 134:
Formación a escala molecular de so
- Page 135 and 136:
Formación a escala molecular de so
- Page 137 and 138:
3µm a Formación a escala molecula
- Page 139 and 140:
Formación a escala molecular de so
- Page 141 and 142:
3µm e Formación a escala molecula
- Page 143 and 144:
3µm a Formación a escala molecula
- Page 145 and 146:
Formación a escala molecular de so
- Page 147 and 148:
4.3.- Discusión Formación a escal
- Page 149 and 150:
Formación a escala molecular de so
- Page 151 and 152:
(1014) (1014) (1014) Formación a e
- Page 153 and 154:
4.3.2- Sistema (Ba,Ca)CO3-H2O Forma
- Page 155 and 156:
Formación a escala molecular de so
- Page 157 and 158:
logΣΠ -5,1 -5,6 -6,1 -6,6 -7,1 -7
- Page 159 and 160:
Formación a escala molecular de so
- Page 161 and 162:
Formación a escala molecular de so
- Page 163 and 164:
1 1 c d β=140 0,9 β=213 0,9 0,8 0
- Page 165 and 166:
Formación a escala molecular de so
- Page 167 and 168:
Formación a escala molecular de so
- Page 169 and 170:
4.3.4- Sistema (Mn,Ca)CO3-H2O Forma
- Page 171 and 172:
Formación a escala molecular de so
- Page 173 and 174:
Formación a escala molecular de so
- Page 175 and 176:
Formación a escala molecular de so
- Page 177 and 178:
-5- CRISTALIZACIÓN DE (Ba,Ca)CO3 Y
- Page 179 and 180:
Cristalización de (Ba,Ca)CO3 y BaC
- Page 181 and 182:
Cristalización de (Ba,Ca)CO3 y BaC
- Page 183 and 184:
Cristalización de (Ba,Ca)CO3 y BaC
- Page 185 and 186:
a) b) Cristalización de (Ba,Ca)CO3
- Page 187 and 188:
Cristalización de (Ba,Ca)CO3 y BaC
- Page 189 and 190:
Cristalización de (Ba,Ca)CO3 y BaC
- Page 191 and 192:
Concentración (mmol/l) 0,035 0,03
- Page 193 and 194:
A/(B+A) 0,6 0,5 0,4 0,3 0,2 0,1 0,0
- Page 195 and 196:
Cristalización de (Ba,Ca)CO3 y BaC
- Page 197 and 198:
Cristalización de (Ba,Ca)CO3 y BaC
- Page 199 and 200:
Cristalización de (Ba,Ca)CO3 y BaC
- Page 201 and 202:
Cristalización de (Ba,Ca)CO3 y BaC
- Page 203 and 204:
Cristalización de (Ba,Ca)CO3 y BaC
- Page 205 and 206:
Cristalización de (Ba,Ca)CO3 y BaC
- Page 207 and 208:
Cristalización de (Ba,Ca)CO3 y BaC
- Page 209 and 210:
Cristalización de (Ba,Ca)CO3 y BaC
- Page 211 and 212:
Cristalización de (Ba,Ca)CO3 y BaC
- Page 213 and 214:
Cristalización de (Ba,Ca)CO3 y BaC
- Page 215 and 216:
Cristalización de (Ba,Ca)CO3 y BaC
- Page 217 and 218:
-6- DISCUSIÓN
- Page 219 and 220:
Discusión la existencia como fase
- Page 221 and 222:
Discusión 5). Sin embargo, la cris
- Page 223 and 224:
-7- CONCLUSIONES
- Page 225 and 226:
Conclusiones 6. Con el fin de carac
- Page 227 and 228:
Conclusiones carbonatos dobles tien
- Page 229 and 230:
Bibliografía Asano, M. y Mugiya, Y
- Page 231 and 232:
Bibliografía Chiarello, R.P.; Woge
- Page 233 and 234:
Bibliografía Garrels, R.M. y Chris
- Page 235 and 236:
Levine, I. (1991): Fisicoquímica.
- Page 237 and 238:
Bibliografía Prieto, M.; Putnis, A
- Page 239 and 240:
Bibliografía Stipp, S.L.S., Konner
- Page 241 and 242:
-9- APÉNDICES
- Page 243 and 244:
Apéndice 1. Cálculo de la especia
- Page 245 and 246:
Apéndice 2. Construcción de diagr
- Page 247 and 248:
TABLA A2.I. Valores de ΣΠ ( B1 C
- Page 249 and 250:
TABLA A2.III. Valores de ΣΠ ( B1
- Page 251 and 252:
Apéndice 3. Representación de dis
- Page 253 and 254:
Apéndice 3. Representación de dis
- Page 255 and 256:
Apéndice 4. Método de Sverjensky
- Page 257 and 258:
Apéndice 4. Método de sverjensky