Ce document est le fruit d'un long travail approuvé par le jury de ...
Ce document est le fruit d'un long travail approuvé par le jury de ...
Ce document est le fruit d'un long travail approuvé par le jury de ...
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
CHAPITRE II : SYNTHÈSE<br />
Enfin l’utilisation du TBDGU dans <strong>le</strong> cas spécifique <strong>de</strong> la 2,2'-diméthyl 6,6'-bipyrazine<br />
nous a permis d’iso<strong>le</strong>r pour la première fois la 2-bromométhyl-2'-méthyl-6,6'-bipyrazine, dérivé<br />
inaccessib<strong>le</strong> via <strong>le</strong>s N-halosuccinimi<strong>de</strong>s (e.g. NBS).<br />
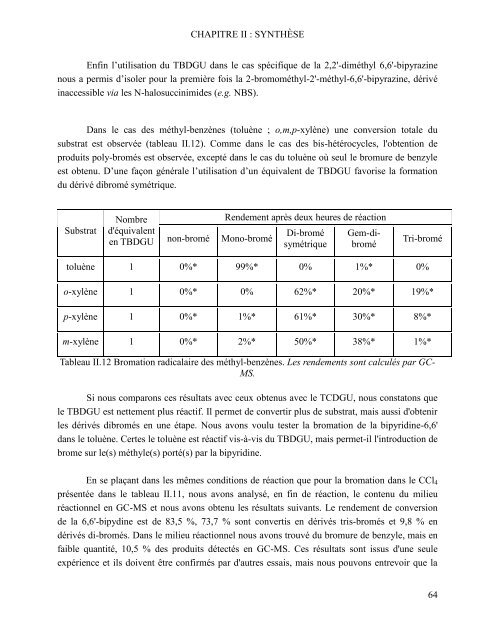
Dans <strong>le</strong> cas <strong>de</strong>s méthyl-benzènes (toluène ; o,m,p-xylène) une conversion tota<strong>le</strong> du<br />
substrat <strong>est</strong> observée (tab<strong>le</strong>au II.12). Comme dans <strong>le</strong> cas <strong>de</strong>s bis-hétérocyc<strong>le</strong>s, l'obtention <strong>de</strong><br />
produits poly-bromés <strong>est</strong> observée, excepté dans <strong>le</strong> cas du toluène où seul <strong>le</strong> bromure <strong>de</strong> benzy<strong>le</strong><br />
<strong>est</strong> obtenu. D’une façon généra<strong>le</strong> l’utilisation d’un équiva<strong>le</strong>nt <strong>de</strong> TBDGU favorise la formation<br />
du dérivé dibromé symétrique.<br />
Substrat<br />
Nombre<br />
d'équiva<strong>le</strong>nt<br />
en TBDGU<br />
Ren<strong>de</strong>ment après <strong>de</strong>ux heures <strong>de</strong> réaction<br />
non-bromé Mono-bromé Di-bromé<br />
symétrique<br />
Gem-dibromé<br />
Tri-bromé<br />
toluène 1 0%* 99%* 0% 1%* 0%<br />
o-xylène 1 0%* 0% 62%* 20%* 19%*<br />
p-xylène 1 0%* 1%* 61%* 30%* 8%*<br />
m-xylène 1 0%* 2%* 50%* 38%* 1%*<br />
Tab<strong>le</strong>au II.12 Bromation radicalaire <strong>de</strong>s méthyl-benzènes. Les ren<strong>de</strong>ments sont calculés <strong>par</strong> GC-<br />
MS.<br />
Si nous com<strong>par</strong>ons ces résultats avec ceux obtenus avec <strong>le</strong> TCDGU, nous constatons que<br />
<strong>le</strong> TBDGU <strong>est</strong> nettement plus réactif. Il permet <strong>de</strong> convertir plus <strong>de</strong> substrat, mais aussi d'obtenir<br />
<strong>le</strong>s dérivés dibromés en une étape. Nous avons voulu t<strong>est</strong>er la bromation <strong>de</strong> la bipyridine-6,6'<br />
dans <strong>le</strong> toluène. <strong>Ce</strong>rtes <strong>le</strong> toluène <strong>est</strong> réactif vis-à-vis du TBDGU, mais permet-il l'introduction <strong>de</strong><br />
brome sur <strong>le</strong>(s) méthy<strong>le</strong>(s) porté(s) <strong>par</strong> la bipyridine.<br />
En se plaçant dans <strong>le</strong>s mêmes conditions <strong>de</strong> réaction que pour la bromation dans <strong>le</strong> CCl4<br />
présentée dans <strong>le</strong> tab<strong>le</strong>au II.11, nous avons analysé, en fin <strong>de</strong> réaction, <strong>le</strong> contenu du milieu<br />
réactionnel en GC-MS et nous avons obtenu <strong>le</strong>s résultats suivants. Le ren<strong>de</strong>ment <strong>de</strong> conversion<br />
<strong>de</strong> la 6,6'-bipydine <strong>est</strong> <strong>de</strong> 83,5 %, 73,7 % sont convertis en dérivés tris-bromés et 9,8 % en<br />
dérivés di-bromés. Dans <strong>le</strong> milieu réactionnel nous avons trouvé du bromure <strong>de</strong> benzy<strong>le</strong>, mais en<br />
faib<strong>le</strong> quantité, 10,5 % <strong>de</strong>s produits détectés en GC-MS. <strong>Ce</strong>s résultats sont issus <strong>d'un</strong>e seu<strong>le</strong><br />
expérience et ils doivent être confirmés <strong>par</strong> d'autres essais, mais nous pouvons entrevoir que la<br />
64