Ergebnisbericht 2010/11 - Helmholtz-Zentrum für Infektionsforschung
Ergebnisbericht 2010/11 - Helmholtz-Zentrum für Infektionsforschung
Ergebnisbericht 2010/11 - Helmholtz-Zentrum für Infektionsforschung
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
94 WISSENSCHAFTLICHER ERGEBNISBERICHT | Infektion und Immunität | Entzündung und Immunität<br />
03.3 Immuneffektoren: Moleküle, Zellen und Mechanismen<br />
PROJEKTLEITER | Dr. Siegfried Weiss | Arbeitsgruppe Molekulare Immunologie | siw@helmholtz-hzi.de<br />
PROJEKTMITARBEITER | Imke Bargen | Nicole Dietrich | Dr. Sandra Düber | Dr. Nelson Gekara |<br />
Dr. Jadwiga Jablonska | Katja Kochrübe | Dr. Sara Leschner | Dr. Stefan Lienenklaus | Dr. Bishnudeo Roy |<br />
Swati Shukla | Evgeniya Solodova | Christian Stern | Dr. Nuno Viegas | Kathrin Wolf | Natalia Zietara<br />
Unser Immunsystem setzt sich aus mehreren Verteidigungslinien<br />
zusammen. Eine der ersten Linien sind die Typ-<br />
I-Interferone (IFN), mit ihren wichtigsten Vertretern IFN-α<br />
und IFN-β. Sie haben antivirale Eigenschaften, werden jedoch<br />
auch bei vielen anderen Infektionen induziert und spielen<br />
bei normalen physiologischen Vorgängen eine wichtige Rolle.<br />
Wir konnten zeigen, dass auch Liganden des Toll-like-receptors<br />
2 (TLR2) Makrophagen IFN induzieren können. TLR2<br />
Liganden fi ndet man auf Gram-positiven Bakterien oder<br />
auf Mykoplasmen. Interessanterweise muss der TLR2 von<br />
den Makrophagen endozytiert werden, um IFN-Produktion<br />
auszulösen. Wird die Endozytose blockiert, so dass der TLR2-<br />
Liganden Komplex an der Zelloberfl äche bleibt, wird nur die<br />
Produktion von proinfl ammatorischen Zytokinen, wie TNF-α,<br />
aktiviert. Also entscheidet die Fähigkeit einer Zelle, TLRs<br />
nach Ligandenbindung zu endozytieren, darüber, ob bei der<br />
Zelle IFN-Produktion über diese TLRs induziert werden kann.<br />
Wir konnten dabei zeigen, dass Mastzellen entsprechende<br />
TLRs nicht endozytieren und auch keine Bakterien phagozytieren<br />
können. Dadurch können sie auf Bakterieninfektionen<br />
nicht mit IFN-Produktion antworten – bei Virusinfektionen<br />
dagegen sehr wohl. Mastzellen sind anatomisch hauptsächlich<br />
unter den verschiedensten Epithelien angesiedelt.<br />
Sie stellen deshalb die ersten Immunzellen dar, die mit<br />
eindringenden Krankheitserregern in Berührung kommen.<br />
Bei Bakterieninfektionen ist die Produktion von IFN häufi g<br />
schädlich. Dass die Mastzellen unter diesen Umständen nur<br />
proinfl ammatorische Zytokine und kein IFN produzieren<br />
können, könnte deshalb einen wohl ausgewogenen Abwehrmechanismus<br />
darstellen.<br />
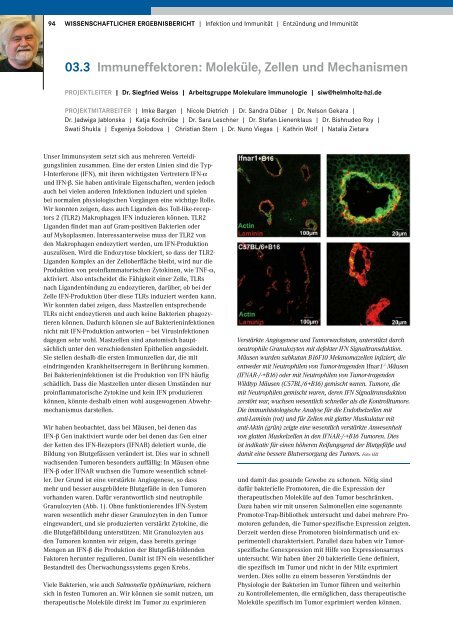
Wir haben beobachtet, dass bei Mäusen, bei denen das<br />
IFN-β Gen inaktiviert wurde oder bei denen das Gen einer<br />
der Ketten des IFN-Rezeptors (IFNAR) deletiert wurde, die<br />
Bildung von Blutgefässen verändert ist. Dies war in schnell<br />
wachsenden Tumoren besonders auffällig: In Mäusen ohne<br />
IFN-β oder IFNAR wuchsen die Tumore wesentlich schneller.<br />
Der Grund ist eine verstärkte Angiogenese, so dass<br />
mehr und besser ausgebildete Blutgefäße in den Tumoren<br />
vorhanden waren. Da<strong>für</strong> verantwortlich sind neutrophile<br />
Granulozyten (Abb. 1). Ohne funktionierendes IFN-System<br />
waren wesentlich mehr dieser Granulozyten in den Tumor<br />
eingewandert, und sie produzierten verstärkt Zytokine, die<br />
die Blutgefäßbildung unterstützen. Mit Granulozyten aus<br />
den Tumoren konnten wir zeigen, dass bereits geringe<br />
Mengen an IFN-β die Produktion der Blutgefäß-bildenden<br />
Faktoren herunter regulieren. Damit ist IFN ein wesentlicher<br />
Bestandteil des Überwachungssystems gegen Krebs.<br />
Viele Bakterien, wie auch Salmonella typhimurium, reichern<br />
sich in festen Tumoren an. Wir können sie somit nutzen, um<br />
therapeutische Moleküle direkt im Tumor zu exprimieren<br />
Verstärkte Angiogenese und Tumorwachstum, unterstützt durch<br />
neutrophile Granulozyten mit defekter IFN Signaltransduktion.<br />
Mäusen wurden subkutan B16F10 Melanomazellen injiziert, die<br />
entweder mit Neutrophilen von Tumor-tragenden Ifnar1 -/- Mäusen<br />
(IFNAR-/-+B16) oder mit Neutrophilen von Tumor-tragenden<br />
Wildtyp Mäusen (C57BL/6+B16) gemischt waren. Tumore, die<br />
mit Neutrophilen gemischt waren, deren IFN Signaltransduktion<br />
zerstört war, wuchsen wesentlich schneller als die Kontrolltumore.<br />
Die immunhistologische Analyse <strong>für</strong> die Endothelzellen mit<br />
anti-Laminin (rot) und <strong>für</strong> Zellen mit glatter Muskulatur mit<br />
anti-Aktin (grün) zeigte eine wesentlich verstärkte Anwesenheit<br />
von glatten Muskelzellen in den IFNAR-/-+B16 Tumoren. Dies<br />
ist indikativ <strong>für</strong> einen höheren Reifungsgrad der Blutgefäße und<br />
damit eine bessere Blutversorgung des Tumors. Foto: HZI<br />
und damit das gesunde Gewebe zu schonen. Nötig sind<br />
da<strong>für</strong> bakterielle Promotoren, die die Expression der<br />
therapeutischen Moleküle auf den Tumor beschränken.<br />
Dazu haben wir mit unseren Salmonellen eine sogenannte<br />
Promotor-Trap-Bibliothek untersucht und dabei mehrere Promotoren<br />
gefunden, die Tumor-spezifi sche Expression zeigten.<br />
Derzeit werden diese Promotoren bioinformatisch und experimentell<br />
charakterisiert. Parallel dazu haben wir Tumorspezifi<br />
sche Genexpression mit Hilfe von Expressionsarrays<br />
untersucht. Wir haben über 20 bakterielle Gene defi niert,<br />
die spezifi sch im Tumor und nicht in der Milz exprimiert<br />
werden. Dies sollte zu einem besseren Verständnis der<br />
Physiologie der Bakterien im Tumor führen und weiterhin<br />
zu Kontrollelementen, die ermöglichen, dass therapeutische<br />
Moleküle spezifi sch im Tumor exprimiert werden können.