Podstawowe procedury laboratoryjne w ... - digicollection.or..
Podstawowe procedury laboratoryjne w ... - digicollection.or..
Podstawowe procedury laboratoryjne w ... - digicollection.or..
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
OZNACZANIE WRAŻLIWOŚCI NA ANTYBIOTYKI<br />
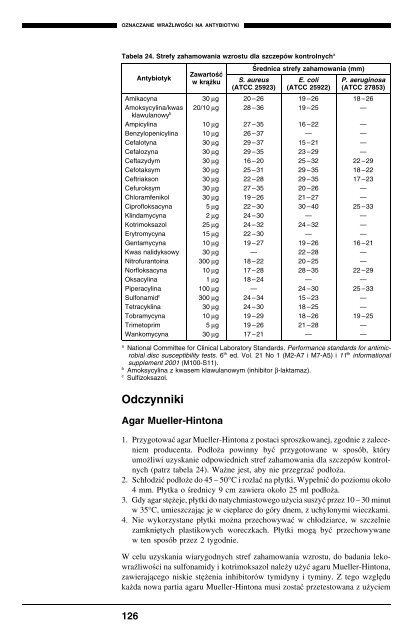
Tabela 24. Strefy zahamowania wzrostu dla szczepów kontrolnych a<br />
a<br />
b<br />
c<br />
Antybiotyk<br />
Zawartość<br />
w kra˛żku<br />
Średnica strefy zahamowania (mm)<br />
S. aureus<br />
(ATCC 25923)<br />
E. coli<br />
(ATCC 25922)<br />
P. aeruginosa<br />
(ATCC 27853)<br />
Amikacyna 30 µg 20–26 19 –26 18 –26<br />
Amoksycylina/kwas 20/10 µg 28–36 19 –25 —<br />
klawulanowy b<br />
Ampicylina 10 µg 27–35 16 –22 —<br />
Benzylopenicylina 10 µg 26–37 — —<br />
Cefalotyna 30 µg 29–37 15 –21 —<br />
Cefalozyna 30 µg 29–35 23 –29 —<br />
Ceftazydym 30 µg 16–20 25 –32 22 –29<br />
Cefotaksym 30 µg 25–31 29 –35 18 –22<br />
Ceftriakson 30 µg 22–28 29 –35 17 –23<br />
Cefuroksym 30 µg 27–35 20 –26 —<br />
Chl<strong>or</strong>amfenikol 30 µg 19–26 21 –27 —<br />
Ciprofloksacyna 5 µg 22–30 30 –40 25 –33<br />
Klindamycyna 2 µg 24–30 — —<br />
Kotrimoksazol 25 µg 24–32 24 –32 —<br />
Erytromycyna 15 µg 22–30 — —<br />
Gentamycyna 10 µg 19–27 19 –26 16 –21<br />
Kwas nalidyksowy 30 µg — 22 –28 —<br />
Nitrofurantoina 300 µg 18–22 20 –25 —<br />
N<strong>or</strong>floksacyna 10 µg 17–28 28 –35 22 –29<br />
Oksacylina 1 µg 18–24 — —<br />
Piperacylina 100 µg — 24 –30 25 –33<br />
Sulfonamid c 300 µg 24–34 15 –23 —<br />
Tetracyklina 30 µg 24–30 18 –25 —<br />
Tobramycyna 10 µg 19–29 18 –26 19 –25<br />
Trimetoprim 5 µg 19–26 21 –28 —<br />
Wankomycyna 30 µg 17–21 — —<br />
National Committee f<strong>or</strong> Clinical Lab<strong>or</strong>at<strong>or</strong>y Standards. Perf<strong>or</strong>mance standards f<strong>or</strong> antimicrobial<br />
disc susceptibility tests. 6 th ed. Vol. 21 No 1 (M2-A7 i M7-A5) i 11 th inf<strong>or</strong>mational<br />
supplement 2001 (M100-S11).<br />
Amoksycylina z kwasem klawulanowym (inhibit<strong>or</strong> β-laktamaz).<br />
Sulfizoksazol.<br />
Odczynniki<br />
Agar Mueller-Hintona<br />
1. Przygotować agar Mueller-Hintona z postaci sproszkowanej, zgodnie z zaleceniem<br />
producenta. Podłoża powinny być przygotowane w sposób, który<br />
umożliwi uzyskanie odpowiednich stref zahamowania dla szczepów kontrolnych<br />
(patrz tabela 24). Ważne jest, aby nie przegrzać podłoża.<br />
2. Schłodzić podłożedo45– 50°C i rozlać na płytki. Wypełnić do poziomu około<br />
4 mm. Płytka o średnicy 9 cm zawiera około 25 ml podłoża.<br />
3. Gdy agar stężeje, płytki do natychmiastowego użycia suszyć przez 10 – 30 minut<br />
w35°C, umieszczając jewcieplarcedogóry dnem, z uchylonymi wieczkami.<br />
4. Nie wyk<strong>or</strong>zystane płytki można przechowywać wchłodziarce, w szczelnie<br />
zamkniętych plastikowych w<strong>or</strong>eczkach. Płytki mogą być przechowywane<br />
w ten sposób przez 2 tygodnie.<br />
W celu uzyskania wiarygodnych stref zahamowania wzrostu, do badania lekowrażliwości<br />
na sulfonamidy i kotrimoksazol należy użyć agaru Mueller-Hintona,<br />
zawierającego niskie stężenia inhibit<strong>or</strong>ów tymidyny i tyminy. Z tego względu<br />
każda nowa partia agaru Mueller-Hintona musi zostać przetestowana z użyciem<br />
126