ASAXS - Helmholtz-Zentrum Berlin
ASAXS - Helmholtz-Zentrum Berlin
ASAXS - Helmholtz-Zentrum Berlin
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
4 Zusätzliche Charakterisierungsmethoden<br />
Die Nachweisgrenze der jeweiligen Elemente hängt von der Zusammensetzung der Probe<br />
ab. Für leichte Elemente in einer Umgebung, bestehend aus schwereren Elementen, können<br />
1 × 10 −1 % nachgewiesen werden. Im Gegensatz zu 1 × 10 −5 % Nachweisempfindlichkeit für<br />
schwerere Elemente in einer Umgebung aus leichten Elementen.<br />
Bei der XRF wird ein Elektron aus einer Rumpfschale eines Atoms durch eine äußere<br />
Einwirkung entfernt. Die entstandene Lücke in der Rumpfschale wird innerhalb von 10 −12 -<br />
10 −14 s durch einen Elektronenübergang aus einer weiter außen liegenden Elektronenschale<br />
aufgefüllt. Dabei kann ein Photon emittiert werden, dessen Energie der Energiedifferenz der<br />
beiden Energieniveaus entspricht. Das emittierte Photon ist elementspezifisch und wird als<br />
charakteristisches Röntgenquant bezeichnet (Abbildung 4.1). Alternativ zur Emission eines<br />
Photons kann ein Auger-Elektron emittiert werden.<br />
Energie (nicht maßstäblich)<br />
Schale K-Serie L-Serie Elektronenzustand<br />
NVII<br />
NVI NV NIV<br />
NIII NII NI<br />
M V<br />
M III<br />
M I<br />
L III<br />
L I<br />
K<br />
M IV<br />
MII<br />
L II<br />
α 2 α 1 β 3 β1<br />
β 4 β 3 γ2 γ3<br />
LI<br />
η β1 γ5 γ1<br />
η α2 α1 β6 β15 β2<br />
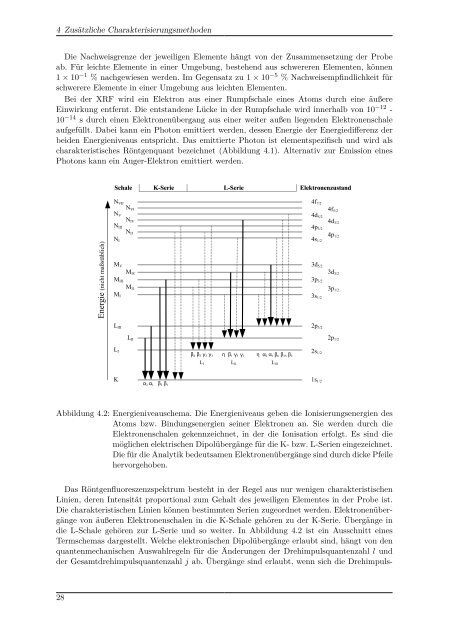
Abbildung 4.2: Energieniveauschema. Die Energieniveaus geben die Ionisierungsenergien des<br />
Atoms bzw. Bindungsenergien seiner Elektronen an. Sie werden durch die<br />
Elektronenschalen gekennzeichnet, in der die Ionisation erfolgt. Es sind die<br />
möglichen elektrischen Dipolübergänge für die K- bzw. L-Serien eingezeichnet.<br />
Die für die Analytik bedeutsamen Elektronenübergänge sind durch dicke Pfeile<br />
hervorgehoben.<br />
Das Röntgenfluoreszenzspektrum besteht in der Regel aus nur wenigen charakteristischen<br />
Linien, deren Intensität proportional zum Gehalt des jeweiligen Elementes in der Probe ist.<br />
Die charakteristischen Linien können bestimmten Serien zugeordnet werden. Elektronenübergänge<br />
von äußeren Elektronenschalen in die K-Schale gehören zu der K-Serie. Übergänge in<br />
die L-Schale gehören zur L-Serie und so weiter. In Abbildung 4.2 ist ein Ausschnitt eines<br />
Termschemas dargestellt. Welche elektronischen Dipolübergänge erlaubt sind, hängt von den<br />
quantenmechanischen Auswahlregeln für die Änderungen der Drehimpulsquantenzahl l und<br />
der Gesamtdrehimpulsquantenzahl j ab. Übergänge sind erlaubt, wenn sich die Drehimpuls-<br />
28<br />
LII<br />
LIII<br />
4f7/2<br />
4d5/2<br />
4p 3/2<br />
4s1/2<br />
3d 5/2<br />
3p 3/2<br />
3s1/2<br />
2p 3/2<br />
2s1/2<br />
1s1/2<br />
4f 5/2<br />
4d 3/2<br />
4p1/2<br />
3d 3/2<br />
3p 1/2<br />
2p 1/2