Immobilisierung
resolver
resolver
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
Ergebnisse und Diskussion<br />
Auftragung der Werte nicht immer gut auszuwerten und leichter anfällig für Fehler ist, ist es<br />
gebräuchlich die reziproken Werte zu verwenden, um damit die Auftragung zu linearisieren.<br />
5<br />
4<br />
4<br />
3<br />
i [µA]<br />
3<br />
i [µA]<br />
2<br />
2<br />
1<br />
1<br />
0<br />
0<br />
-0,2 0,0 0,2 0,4<br />
E [V vs. Ag/AgCl]<br />
-0,2 0,0 0,2 0,4<br />
E [V vs. Ag/AgCl]<br />
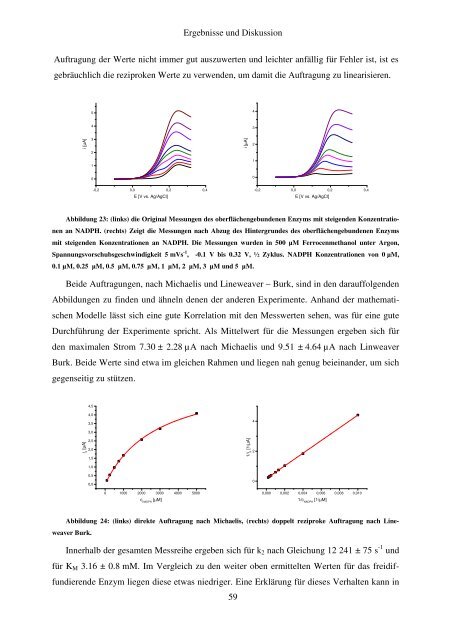
Abbildung 23: (links) die Original Messungen des oberflächengebundenen Enzyms mit steigenden Konzentrationen<br />
an NADPH. (rechts) Zeigt die Messungen nach Abzug des Hintergrundes des oberflächengebundenen Enzyms<br />
mit steigenden Konzentrationen an NADPH. Die Messungen wurden in 500 µM Ferrocenmethanol unter Argon,<br />
Spannungsvorschubsgeschwindigkeit 5 mVs -1 , -0.1 V bis 0.32 V, ½ Zyklus. NADPH Konzentrationen von 0 µM,<br />
0.1 µM, 0.25 µM, 0.5 µM, 0.75 µM, 1 µM, 2 µM, 3 µM und 5 µM.<br />
Beide Auftragungen, nach Michaelis und Lineweaver – Burk, sind in den darauffolgenden<br />
Abbildungen zu finden und ähneln denen der anderen Experimente. Anhand der mathematischen<br />
Modelle lässt sich eine gute Korrelation mit den Messwerten sehen, was für eine gute<br />
Durchführung der Experimente spricht. Als Mittelwert für die Messungen ergeben sich für<br />
den maximalen Strom 7.30 ± 2.28 µA nach Michaelis und 9.51 ± 4.64 µA nach Linweaver<br />
Burk. Beide Werte sind etwa im gleichen Rahmen und liegen nah genug beieinander, um sich<br />
gegenseitig zu stützen.<br />
4,5<br />
4,0<br />
3,5<br />
4<br />
i p<br />
[µA]<br />
3,0<br />
2,5<br />
2,0<br />
1,5<br />
1,0<br />
0,5<br />
0,0<br />
1/i p<br />
[1/µA]<br />
2<br />
0<br />
0 1000 2000 3000 4000 5000<br />
c NADPH<br />
[µM]<br />
0,000 0,002 0,004 0,006 0,008 0,010<br />
1/c NADPH<br />
[1/µM]<br />
Abbildung 24: (links) direkte Auftragung nach Michaelis, (rechts) doppelt reziproke Auftragung nach Lineweaver<br />
Burk.<br />
Innerhalb der gesamten Messreihe ergeben sich für k 2 nach Gleichung 12 241 ± 75 s -1 und<br />
für K M 3.16 ± 0.8 mM. Im Vergleich zu den weiter oben ermittelten Werten für das freidiffundierende<br />
Enzym liegen diese etwas niedriger. Eine Erklärung für dieses Verhalten kann in<br />
59