Skript zur Vorlesung
Skript zur Vorlesung
Skript zur Vorlesung
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
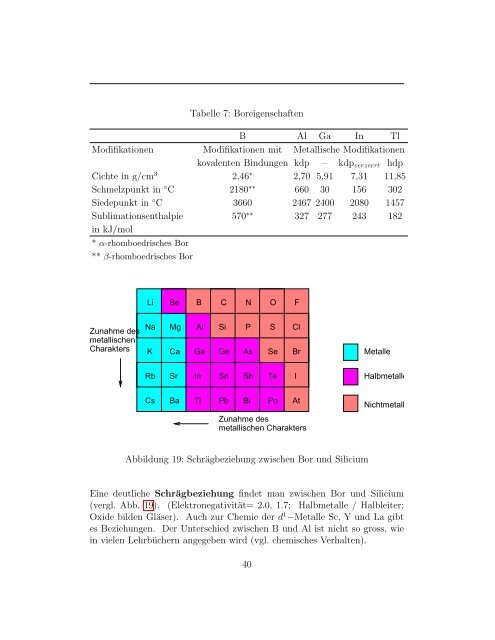
Tabelle 7: Boreigenschaften<br />
B Al Ga In Tl<br />
Modifikationen Modifikationen mit Metallische Modifikationen<br />
kovalenten Bindungen kdp – kdpverzerrt hdp<br />
Cichte in g/cm 3 2,46 ∗ 2,70 5,91 7,31 11,85<br />
Schmelzpunkt in ◦ C 2180 ∗∗ 660 30 156 302<br />
Siedepunkt in ◦ C 3660 2467 2400 2080 1457<br />
Sublimationsenthalpie 570 ∗∗ 327 277 243 182<br />
in kJ/mol<br />
* α-rhomboedrisches Bor<br />
** β-rhomboedrisches Bor<br />
Zunahme des<br />
metallischen<br />
Charakters<br />
Li<br />
K<br />
Ca<br />
Rb Sr<br />
Cs<br />
Be<br />
Na Mg<br />
B C N O F<br />
Al<br />
Si<br />
P<br />
Cl<br />
Ga Ge As Se Br<br />
In Sn Sb<br />
S<br />
Ba Tl Pb Bi Po<br />
Te I<br />
At<br />
Zunahme des<br />
metallischen Charakters<br />
Abbildung 19: Schrägbeziehung zwischen Bor und Silicium<br />
Metalle<br />
Halbmetalle<br />
Nichtmetalle<br />
Eine deutliche Schrägbeziehung findet man zwischen Bor und Silicium<br />
(vergl. Abb. 19). (Elektronegativität= 2.0, 1.7; Halbmetalle / Halbleiter;<br />
Oxide bilden Gläser). Auch <strong>zur</strong> Chemie der d 1 −Metalle Sc, Y und La gibt<br />
es Beziehungen. Der Unterschied zwischen B und Al ist nicht so gross, wie<br />
in vielen Lehrbüchern angegeben wird (vgl. chemisches Verhalten).<br />
40