Zalfa NOUR Modélisation de l'adsorption des molécules à fort ...
Zalfa NOUR Modélisation de l'adsorption des molécules à fort ...
Zalfa NOUR Modélisation de l'adsorption des molécules à fort ...
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
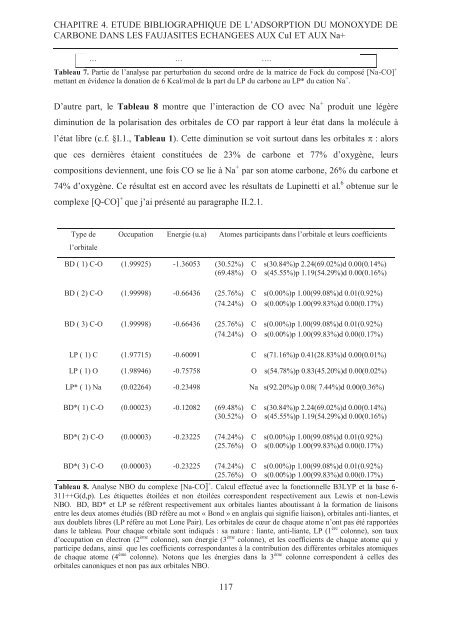
CHAPITRE 4. ETUDE BIBLIOGRAPHIQUE DE L’ADSORPTION DU MONOXYDE DECARBONE DANS LES FAUJASITES ECHANGEES AUX CuI ET AUX Na+… … ….Tableau 7. Partie <strong>de</strong> l’analyse par perturbation du second ordre <strong>de</strong> la matrice <strong>de</strong> Fock du composé [Na-CO] +mettant en évi<strong>de</strong>nce la donation <strong>de</strong> 6 Kcal/mol <strong>de</strong> la part du LP du carbone au LP* du cation Na + .D’autre part, le Tableau 8 montre que l’interaction <strong>de</strong> CO avec Na + produit une légèrediminution <strong>de</strong> la polarisation <strong>de</strong>s orbitales <strong>de</strong> CO par rapport à leur état dans la molécule àl’état libre (c.f. §I.1., Tableau 1). Cette diminution se voit surtout dans les orbitales : alorsque ces <strong>de</strong>rnières étaient constituées <strong>de</strong> 23% <strong>de</strong> carbone et 77% d’oxygène, leurscompositions <strong>de</strong>viennent, une fois CO se lie à Na + par son atome carbone, 26% du carbone et74% d’oxygène. Ce résultat est en accord avec les résultats <strong>de</strong> Lupinetti et al. 6 obtenue sur lecomplexe [Q-CO] + que j’ai présenté au paragraphe II.2.1.Type <strong>de</strong>l’orbitaleOccupation Energie (u.a) Atomes participants dans l’orbitale et leurs coefficientsBD ( 1) C-O (1.99925) -1.36053 (30.52%) C s(30.84%)p 2.24(69.02%)d 0.00(0.14%)(69.48%) O s(45.55%)p 1.19(54.29%)d 0.00(0.16%)BD ( 2) C-O (1.99998) -0.66436 (25.76%) C s(0.00%)p 1.00(99.08%)d 0.01(0.92%)(74.24%) O s(0.00%)p 1.00(99.83%)d 0.00(0.17%)BD ( 3) C-O (1.99998) -0.66436 (25.76%) C s(0.00%)p 1.00(99.08%)d 0.01(0.92%)(74.24%) O s(0.00%)p 1.00(99.83%)d 0.00(0.17%)LP ( 1) C (1.97715) -0.60091 C s(71.16%)p 0.41(28.83%)d 0.00(0.01%)LP ( 1) O (1.98946) -0.75758 O s(54.78%)p 0.83(45.20%)d 0.00(0.02%)LP* ( 1) Na (0.02264) -0.23498 Na s(92.20%)p 0.08( 7.44%)d 0.00(0.36%)BD*( 1) C-O (0.00023) -0.12082 (69.48%) C s(30.84%)p 2.24(69.02%)d 0.00(0.14%)(30.52%) O s(45.55%)p 1.19(54.29%)d 0.00(0.16%)BD*( 2) C-O (0.00003) -0.23225 (74.24%) C s(0.00%)p 1.00(99.08%)d 0.01(0.92%)(25.76%) O s(0.00%)p 1.00(99.83%)d 0.00(0.17%)BD*( 3) C-O (0.00003) -0.23225 (74.24%) C s(0.00%)p 1.00(99.08%)d 0.01(0.92%)(25.76%) O s(0.00%)p 1.00(99.83%)d 0.00(0.17%)Tableau 8. Analyse NBO du complexe [Na-CO] + . Calcul effectué avec la fonctionnelle B3LYP et la base 6-311++G(d,p). Les étiquettes étoilées et non étoilées correspon<strong>de</strong>nt respectivement aux Lewis et non-LewisNBO. BD, BD* et LP se réfèrent respectivement aux orbitales liantes aboutissant à la formation <strong>de</strong> liaisonsentre les <strong>de</strong>ux atomes étudiés (BD réfère au mot « Bond » en anglais qui signifie liaison), orbitales anti-liantes, etaux doublets libres (LP réfère au mot Lone Pair). Les orbitales <strong>de</strong> cœur <strong>de</strong> chaque atome n’ont pas été rapportéesdans le tableau. Pour chaque orbitale sont indiqués : sa nature : liante, anti-liante, LP (1 ère colonne), son tauxd’occupation en électron (2 ème colonne), son énergie (3 ème colonne), et les coefficients <strong>de</strong> chaque atome qui yparticipe <strong>de</strong>dans, ainsi que les coefficients correspondantes à la contribution <strong>de</strong>s différentes orbitales atomiques<strong>de</strong> chaque atome (4 ème colonne). Notons que les énergies dans la 3 ème colonne correspon<strong>de</strong>nt à celles <strong>de</strong>sorbitales canoniques et non pas aux orbitales NBO.117