Хемија, уџбеник за први разред гимназије, Нови Логос
- No tags were found...
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
4. ХЕМИЈСКЕ ВЕЗЕ<br />
Живот… то су везе<br />
између молекула.<br />
Л. Пoлинг<br />
Ван дер Валсове силе<br />
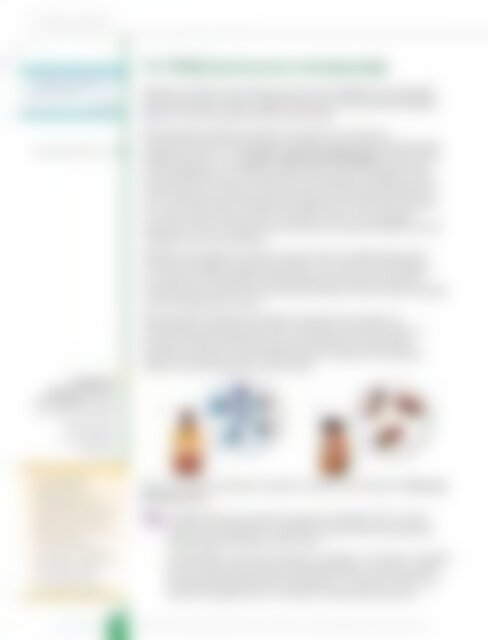
Слика 4.16.<br />
Међумолекулске<br />
интеракције између:<br />
а) поларних молекула<br />
– дипол–дипол<br />
интеракције,<br />
б) неполарних<br />
молекула<br />
4.4. Меумолекулске интеракције<br />
змеђу молекула супстанци увек постоје одређене интеракције<br />
дејства. ачина и врста међумолекулских интеракција одређују<br />
физичка својства ковалентних супстанци.<br />
нтеракције између поларних молекула последица су<br />
електростатичког привлачења између супротно наелектрисаних<br />
крајева дипола и то су диполдипол интеракције слика .16a.<br />
Те интеракције су слабије од јонске везе у јонским кристалима<br />
или ковалентне везе у молекулима. На пример, потребно је само<br />
16 k енергије по једном молу молекула хлороводоника Cl да<br />
би се молекули при испаравању раздвојили и супстанца прешла<br />
из течног агрегатног стања у гасовито, док је <strong>за</strong> раскидање<br />
ковалентне везе између атома водоника и хлора потребно 31 k<br />
eнергије по молу молекула.<br />
змеђу неполарних молекула делују много слабије привлачне<br />
силе него између поларних молекула. Те слабе силе последица<br />
су сложених интеракција између молекула, односно њихових<br />
електронских омотача слика .16б. Oвакве силе постоје и између<br />
атома племенитих гасова.<br />
нтеракције између неполарних молекула последица су<br />
Лондонових дисперзионих сила, које брзо настају, али брзо и<br />
нестају. У једном тренутку један од молекула постаје дипол<br />
тренутни дипол, <strong>за</strong>тим индукује дипол у другом молекулу, с<br />
којим се <strong>за</strong>тим привлачи тим силама.<br />
а)<br />
Хлороформ<br />
δ+ δ –<br />
δ+<br />
δ–<br />
δ–<br />
δ+ δ –<br />
+ δ–<br />
δ+ δ –<br />
б)<br />
Уколико добро<br />
научиш врсте<br />
међумолекулских<br />
интеракција, лако ћеш<br />
надаље описивати и<br />
објашњавати својства<br />
великог броја<br />
супстанци. То ће ти<br />
користити у наредним<br />
курсевима хемије,<br />
aли и биологије,<br />
географије и физике.<br />
есто се све интеракције између молекула означавају као Ван дер<br />
Валсове силе.<br />
РАЗМИСЛИ: масе молекула водоник-сулфида (Н 2 S) и атома<br />
аргона (Ar) приближно су једнаке. Која супстанца има вишу<br />
температуру кључања и због чега?<br />
ОБЈАШЊЕЊЕ: молекули водоник-сулфида су поларни и између<br />
њих постоје дипол–дипол интеракције које су јаче од слабих<br />
интеракција између атома племенитог гаса аргона. Због тога<br />
водоник-сулфид кључа на вишој температури од аргона.<br />
Забрањено је репродуковање, умножавање, дистрибуција, обј<br />
ављивање, прерада и друга употреба овог ауторског дела или његових делова у било ком обиму и поступку, укључујуј<br />
ући<br />
фотокопирање, штампање, чув а110 ње<br />
у електронском облику, односно чињење дела доступним јавности жичним или бежичним путем на начин кој<br />
и омогућујуј<br />
е пој<br />
единцу индивидуални приступ делу<br />
са места и у време кој<br />
е он одабере, без писмене сагласности издавача. Свако неовлашћено коришћење овог ауторског дела представља кршење Закона о ауторском и сродним правима.