Хемија, уџбеник за први разред гимназије, Нови Логос
- No tags were found...
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
Промена енталпије Н реакције једнака је топлоти реакције<br />
при константном притиску Q p ).<br />
Пре и после хемијске реакције укупна енталпија система нема<br />
исту вредност, а с обзиром на то да је енталпија функција стања<br />
система, пут и начин на који се до крајњег стања краја реакције<br />
дошло не утиче на укупну количину ве<strong>за</strong>не или ослобођене<br />
топлоте стр. 193. Због тога се промена енталпије реакције може<br />
изразити као разлика збира свих енталпија производа хемијске<br />
реакције и збира енталпија реактаната.<br />
производа<br />
– реактаната<br />
За егзотермне реакције важи да промена енталпије има негативну<br />
вредност 0, а <strong>за</strong> ендотермне реакције позитивну вредност<br />
0.<br />
Енергија активације<br />
Већина хемијских реакција не почиње уколико се реактантима<br />
не доведе одређена количина енергије на почетку реакције. На<br />
пример, водоник и кисеоник помешани на собној температури не<br />
реагују без обзира на то што је њихова реакција веома егзотермна.<br />
Да би дошло до реакције водоника и кисеоника, потребно је<br />
довести одређену количину енергије, на пример у облику топлотне<br />
енергије, а након тога се реакција дешава уз ослобађање топлоте<br />
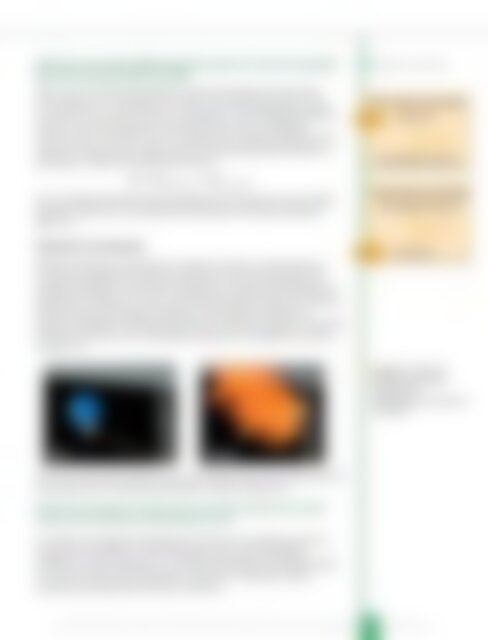
слика 7.7.<br />
Промена енталпије<br />
Eгзотермне реакције<br />
Топлота РЕАКТАНТИ<br />
ΔH < 0<br />
ПРОИЗВОДИ РЕАКЦИЈЕ<br />
Eндотермне реакције<br />
ПРОИЗВОДИ РЕАКЦИЈЕ<br />
ΔH > 0<br />
Топлота РЕАКТАНТИ<br />
Слика 7.7. Паљење<br />
балона напуњеног<br />
водоником<br />
приношењем упаљеног<br />
штапића<br />
Пре<br />
После<br />
Почетна количина енергије која активира реактанте тако да могу<br />
да реагују, јесте енергија активације и њена ознака је а .<br />
Енергија активације је минимална количина енергије коју треба<br />
довести реактантима да би реакција почела.<br />
У случају егзотермних реакција на почетку је потребно довести<br />
енергију активације, а <strong>за</strong>тим реакција сама себи обезбеђује<br />
енергију <strong>за</strong> даље одвијање. У случају ендотермних реакција везује<br />
се топлота током целе реакције и уколико се прекине довод<br />
енергије, реакција престаје да се дешава.<br />
Забрањено је репродуковање, умножавање, дистрибуција, обј<br />
ављивање, прерада и друга употреба овог ауторског дела или његових делова у било ком обиму и поступку, укључујуј<br />
ући<br />
фотокопирање, штампање, чување у електронском облику, односно чињење дела доступним јавности жичним или бежичним путем на начин кој<br />
и омогућујуј<br />
е по ј197 е197 дин<br />
цу<br />
индивидуални приступ делу<br />
са места и у време кој<br />
е он одабере, без писмене сагласности издавача. Свако неовлашћено коришћење овог ауторског дела представља кршење Закона о ауторском и сродним правима.