Хемија, уџбеник за први разред гимназије, Нови Логос
- No tags were found...
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
7. ХЕМИЈСКЕ РЕАКЦИЈЕ<br />
Уколико се смањује концентрација учесника реакције, равнотежа<br />
се помера тако да постаје бржа реакција настајања тог учесника<br />
реакције. На пример, ако се смањи концентрација супстанце В,<br />
уклањањем из реакционе смеше, брзина повратне реакције се<br />
смањује и равнотежа се помера у смеру настајања супстанцe В, тј.<br />
удесно.<br />
ПРИМЕР 7.14. Утицај промене концентрације учесника реакције<br />
на положај равнотеже<br />
У којем ће се смеру померити равнотежа реакције синтезе амонијака уколико се:<br />
а) у равнотежну смешу дода амонијак, б) из равнотежне смеше уклони азот?<br />
Једначина реакције: 3H 2 (g) + N 2 (g) 2NH 3 (g)<br />
РЕШЕЊЕ<br />
а) Повећањем концентрације<br />
одређеног учесника реакције,<br />
равнотежа се помера у смеру<br />
његовог разлагања. У овом случају<br />
равнотежа се помера улево.<br />
б) Када се смањи концентрација азота,<br />
равнотежа се помера у смеру његовог<br />
настајања, тј. у овом случају улево,<br />
што доводи до смањења равнотежне<br />
концентрације амонијака.<br />
Утицај притиска на равнотежу<br />
У случају гасовитих учесника равнотежне реакције, притисак<br />
знатно утиче на положај равнотеже. Притисак у посуди у којој се<br />
дешава реакција може се променити смањењем или повећањем<br />
<strong>за</strong>премине суда. При смањењу <strong>за</strong>премине, повећавају се<br />
парцијални притисци гасова, а тиме и њихове концентрације, чиме<br />
се мењају брзине директне и повратне реакције, као и положај<br />
равнотеже. Супротно томе делује повећање <strong>за</strong>премине, тј. смањење<br />
притиска у реакционом суду.<br />
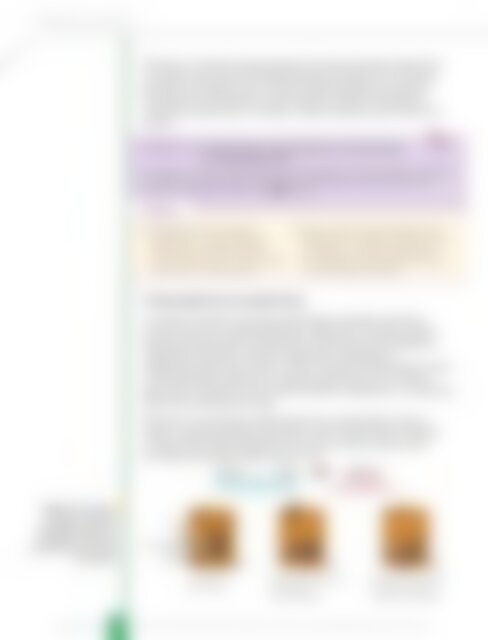
Уколико се, на пример, повећа притисак у равнотежном суду у<br />
којем се дешава реакција водоника и азота, равнотежа се помера<br />
у смеру мањег броја молекула гаса, што је у овом случају смер<br />
настајања амонијака N 3 слика 7.27.<br />
3H 2 (g) + N 2 (g) 2NH 3<br />
(g)<br />
Четири молекула гаса<br />
Два молекула гаса<br />
Слика 7.27. Приказ<br />
утицаја смањења<br />
<strong>за</strong>премине односно<br />
повећања притиска<br />
на равнотежу синтезе<br />
амонијака<br />
NH 3<br />
N 2<br />
H 2<br />
Систем је у<br />
равнотежи.<br />
Смањење <strong>за</strong>премине:<br />
повећавају се<br />
концентрације.<br />
Равнотежа се помера<br />
у смеру настајања<br />
молекула амонијака.<br />
Забрањено је репродуковање, умножавање, дистрибуција, обј<br />
ављивање, прерада и друга употреба овог ауторског дела или његових делова у било ком обиму и поступку, укључујуј<br />
ући<br />
фотокопирање, штампање, чув а220 ње<br />
у електронском облику, односно чињење дела доступним јавности жичним или бежичним путем на начин кој<br />
и омогућујуј<br />
е пој<br />
единцу индивидуални приступ делу<br />
са места и у време кој<br />
е он одабере, без писмене сагласности издавача. Свако неовлашћено коришћење овог ауторског дела представља кршење Закона о ауторском и сродним правима.