Хемија, уџбеник за први разред гимназије, Нови Логос
- No tags were found...
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
6. КОНЦЕПТ МОЛА И СТЕХИОМЕТРИЈА<br />
Моларна маса<br />
У чаши има 6,022 . 10<br />
23<br />
оваквих молекула.<br />
Везу између масе и количине супстанце представља моларна<br />
маса. Ознака <strong>за</strong> моларну масу је M, a јединица g/mol слика 6.7.<br />
По бројчаној вредности моларна маса супстанци једнака је<br />
релативнo атомскo, односно релативнo молекулскo маси.<br />
М m М = А r g/mol<br />
n<br />
M = M r g/mol<br />
Ознака m је ознака <strong>за</strong> масу супстанце, а n <strong>за</strong> количину супстанце.<br />
Moларна маса<br />
1 mol H 2 O<br />
(18,0 g)<br />
Количина супстанце (n)<br />
Moларна маса<br />
Maса супстанце (m)<br />
1 молекул воде<br />
(18,0 . 1,6605 . 10 –23 g)<br />
Слика 6.6.<br />
Концепт мола.<br />
Један мол молекула воде<br />
садржи Авогадров број<br />
молекула и има масу која<br />
одговара моларноj<br />
маси воде.<br />
ПРИМЕР 5.7. Израчунавање масе на основу количине супстанце<br />
Колико износи маса узорка амонијака који садржи 3,28 mol молекула те<br />
супстанце? (М(NH 3 ) = 17 g/mol)<br />
РЕШЕЊЕ<br />
I начин<br />
m = n . M = 3,28 mol . 17 g/mol<br />
m = 55,76 g<br />
II начин<br />
На основу моларне масе може се<br />
поставити пропорција:<br />
17 g : 1 mol = x : 3,28 mol<br />
х = 55,76 g<br />
ПРИМЕР 5.8. Израчунавање броја молекула на основу масе супстанце<br />
Колико молекула има у 1,8 g дестиловане воде? М(Н 2 О) = 18 g/mol<br />
РЕШЕЊЕ<br />
I начин<br />
m<br />
n =<br />
M = 1,8 g<br />
= 0,1 mol<br />
18 g/mol<br />
N = n . N A<br />
= 0,1 mol . 6 . 10 23 1/mol<br />
N = 0,6 . 10 23 = 6,0 . 10 22 молекула воде<br />
II начин<br />
Може се поставити пропорција:<br />
x : 1,8 g = 6 . 10 23 молекула : 18 g<br />
х = 6,0 . 10 22 молекула воде<br />
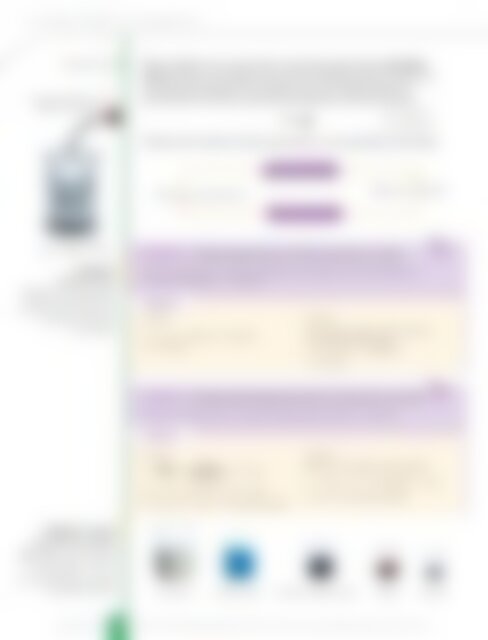
Слика 6.7. Узорци<br />
супстанци количине<br />
од 1 mol. У свим чашама<br />
има једнак број основних<br />
честица (6,022 . 10 23 ), а<br />
масе одговарају њиховим<br />
моларним масама. сахаро<strong>за</strong> плави камен калијум-перманганат бакар гвожђе<br />
Забрањено је репродуковање, умножавање, дистрибуција, обј<br />
ављивање, прерада и друга употреба овог ауторског дела или његових делова у било ком обиму и поступку, укључујуј<br />
ући<br />
фотокопирање, штампање, чув а172 ње<br />
у електронском облику, односно чињење дела доступним јавности жичним или бежичним путем на начин кој<br />
и омогућујуј<br />
е пој<br />
единцу индивидуални приступ делу<br />
са места и у време кој<br />
е он одабере, без писмене сагласности издавача. Свако неовлашћено коришћење овог ауторског дела представља кршење Закона о ауторском и сродним правима.