Angelika Semmler - KOPS - Universität Konstanz
Angelika Semmler - KOPS - Universität Konstanz
Angelika Semmler - KOPS - Universität Konstanz
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
5 Anwendung der Methode<br />
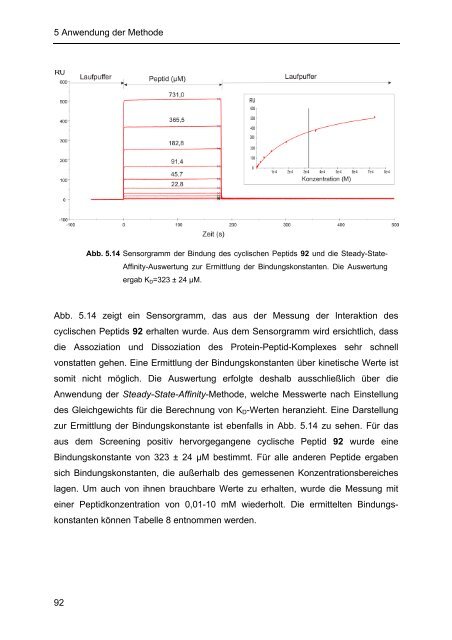
Abb. 5.14 Sensorgramm der Bindung des cyclischen Peptids 92 und die Steady-State-<br />
Affinity-Auswertung zur Ermittlung der Bindungskonstanten. Die Auswertung<br />
ergab KD=323 ± 24 µM.<br />
Abb. 5.14 zeigt ein Sensorgramm, das aus der Messung der Interaktion des<br />
cyclischen Peptids 92 erhalten wurde. Aus dem Sensorgramm wird ersichtlich, dass<br />
die Assoziation und Dissoziation des Protein-Peptid-Komplexes sehr schnell<br />
vonstatten gehen. Eine Ermittlung der Bindungskonstanten über kinetische Werte ist<br />
somit nicht möglich. Die Auswertung erfolgte deshalb ausschließlich über die<br />
Anwendung der Steady-State-Affinity-Methode, welche Messwerte nach Einstellung<br />
des Gleichgewichts für die Berechnung von KD-Werten heranzieht. Eine Darstellung<br />
zur Ermittlung der Bindungskonstante ist ebenfalls in Abb. 5.14 zu sehen. Für das<br />
aus dem Screening positiv hervorgegangene cyclische Peptid 92 wurde eine<br />
Bindungskonstante von 323 ± 24 µM bestimmt. Für alle anderen Peptide ergaben<br />
sich Bindungskonstanten, die außerhalb des gemessenen Konzentrationsbereiches<br />
lagen. Um auch von ihnen brauchbare Werte zu erhalten, wurde die Messung mit<br />
einer Peptidkonzentration von 0,01-10 mM wiederholt. Die ermittelten Bindungs-<br />
konstanten können Tabelle 8 entnommen werden.<br />
92