- Seite 1 und 2:
Neue Methoden zur Sequenzierung fes
- Seite 3:
meinem Großvater Albert Anton Höf
- Seite 6 und 7:
Vorwort Natürlich gibt es ein Lebe
- Seite 8 und 9:
Inhaltsverzeichnis 4 ANALYTIK 47 4.
- Seite 10 und 11:
Inhaltsverzeichnis 8.6 SPR-Experime
- Seite 12 und 13:
Abkürzungen DMF N,N’-Dimethylfor
- Seite 14 und 15:
Abkürzungen TG Tenta Gel Thi Thien
- Seite 16 und 17:
1 Einleitung Echinocandin 2 (Abb. 1
- Seite 18 und 19:
1 Einleitung 1.2 Cyclopeptidbibliot
- Seite 20 und 21:
1 Einleitung 1.3 Die Problematik de
- Seite 22 und 23:
1 Einleitung Eine weitere Möglichk
- Seite 24 und 25:
1 Einleitung 1.4 Fluoreszenzmarkier
- Seite 27 und 28:
2 Aufgabenstellung 2.1 Analytik von
- Seite 29 und 30:
3 Sollbruchstellen 3 Sollbruchstell
- Seite 31 und 32:
3 Sollbruchstellen Abb. 3.3 Der Fmo
- Seite 33 und 34:
3 Sollbruchstellen Die erhaltenen C
- Seite 35 und 36:
3 Sollbruchstellen Abb. 3.8 Ausschn
- Seite 37 und 38:
3 Sollbruchstellen Bestrahlung für
- Seite 39 und 40:
3 Sollbruchstellen HSQC-, TOCSY- un
- Seite 41 und 42:
3 Sollbruchstellen Neben der Bromcy
- Seite 43 und 44:
3 Sollbruchstellen Die Synthese des
- Seite 45 und 46:
3.2.1.1 Der Arylhydrazin-Linker 3 S
- Seite 47 und 48:
3 Sollbruchstellen Aminosäureester
- Seite 49 und 50:
3 Sollbruchstellen Beide Linker wur
- Seite 51 und 52:
3 Sollbruchstellen Zur Erstellung d
- Seite 53 und 54:
3 Sollbruchstellen 39
- Seite 55 und 56:
3 Sollbruchstellen Die Literaturaus
- Seite 57 und 58:
3 Sollbruchstellen Zur anschließen
- Seite 59 und 60:
3 Sollbruchstellen erfolgte die Cyc
- Seite 61 und 62:
4 Analytik 4 Analytik Wie bereits i
- Seite 63 und 64:
4 Analytik Fragmentionen der Seiten
- Seite 65 und 66: 4 Analytik Abb. 4.4 MS(2) Spektrum
- Seite 67 und 68: 4 Analytik Tabelle 4 Peakliste der
- Seite 69 und 70: 4 Analytik Abb. 4.6 Summe aller MS(
- Seite 71 und 72: N C S Phenylisothiocyanat Kupplung
- Seite 73 und 74: 4 Analytik machen [91-94] . Mit dem
- Seite 75 und 76: 4.2.3.1 Anwendung des Konzepts auf
- Seite 77 und 78: 4 Analytik Abb. 4.11 MALDI-TOF Mass
- Seite 79 und 80: 4 Analytik präparativer RP-HPLC au
- Seite 81 und 82: 4.2.3.3 Anwendung des Konzepts auf
- Seite 83 und 84: 4 Analytik Der Vergleich verschiede
- Seite 85 und 86: 5 Anwendung der Methode 5 Anwendung
- Seite 87 und 88: 5 Anwendung der Methode Bindungstas
- Seite 89 und 90: 5.2 Aufbau einer OBOC-Cyclopeptidbi
- Seite 91 und 92: 5.3 Das Screening 5 Anwendung der M
- Seite 93 und 94: 5 Anwendung der Methode Tabelle 6
- Seite 95 und 96: 5 Anwendung der Methode (pH 7-9.2)
- Seite 97 und 98: 5.4 Die Hitbead-Peptidsequenzen 5 A
- Seite 99 und 100: Xaa2 Position Xaa3 Xaa4 Xaa5 Xaa6 A
- Seite 101 und 102: 5.5.1 Synthese der ausgesuchten Pep
- Seite 103 und 104: 5 Anwendung der Methode Oberfläche
- Seite 105 und 106: 5 Anwendung der Methode Die Immobil
- Seite 107: Verbindungsnr. Linear/Cyclisch 5 An
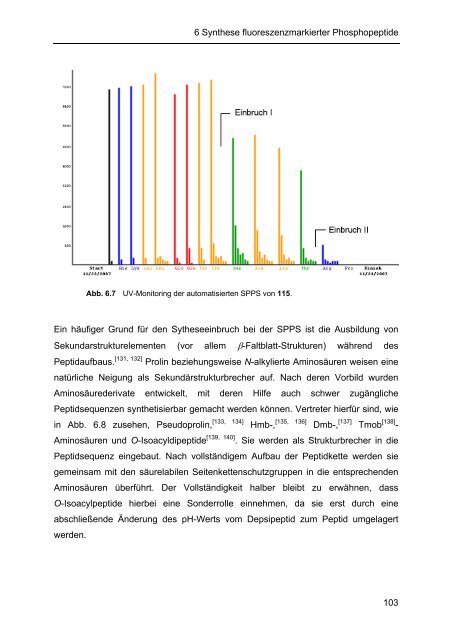
- Seite 110 und 111: 6 Synthese fluoreszenzmarkierter Ph
- Seite 112 und 113: 6 Synthese fluoreszenzmarkierter Ph
- Seite 114 und 115: 6 Synthese fluoreszenzmarkierter Ph
- Seite 118 und 119: 6 Synthese fluoreszenzmarkierter Ph
- Seite 120 und 121: 6 Synthese fluoreszenzmarkierter Ph
- Seite 122 und 123: 6 Synthese fluoreszenzmarkierter Ph
- Seite 124 und 125: 7 Zusammenfassung und Ausblick sich
- Seite 126 und 127: 7 Zusammenfassung und Ausblick Konz
- Seite 128 und 129: 7 Zusammenfassung und Ausblick Bind
- Seite 130 und 131: 7 Zusammenfassung und Ausblick Auch
- Seite 132 und 133: 8 Experimenteller Teil 1046,54 m/z,
- Seite 134 und 135: 8 Experimenteller Teil 8.2 Allgemei
- Seite 136 und 137: 8 Experimenteller Teil AAV 6 Bestim
- Seite 138 und 139: 8 Experimenteller Teil geladen. Das
- Seite 140 und 141: 8 Experimenteller Teil sowie eine 0
- Seite 142 und 143: 8 Experimenteller Teil AAV 16 Basis
- Seite 144 und 145: 8 Experimenteller Teil für eine St
- Seite 146 und 147: 8 Experimenteller Teil Cyclo[Pll-Gl
- Seite 148 und 149: 8 Experimenteller Teil 8.3.2 Synthe
- Seite 150 und 151: 8 Experimenteller Teil 8.3.3 Synthe
- Seite 152 und 153: 8 Experimenteller Teil 8.3.4 Synthe
- Seite 154 und 155: 8 Experimenteller Teil 8.3.5 Synthe
- Seite 156 und 157: 8 Experimenteller Teil 8.3.7 Synthe
- Seite 158 und 159: 8 Experimenteller Teil 8.3.8.1 Tryp
- Seite 160 und 161: 8 Experimenteller Teil 8.3.8.4 Synt
- Seite 162 und 163: 8 Experimenteller Teil HPQ-Motiv, a
- Seite 164 und 165: 8 Experimenteller Teil 8.3.10 Synth
- Seite 166 und 167:
8 Experimenteller Teil SRBS-pY241 S
- Seite 168 und 169:
8 Experimenteller Teil Fmoc-Pro-Arg
- Seite 170 und 171:
8 Experimenteller Teil 8.4 Modell i
- Seite 172 und 173:
8 Experimenteller Teil 8.5 On-bead-
- Seite 174 und 175:
8 Experimenteller Teil 8.5.3 Enzymg
- Seite 176 und 177:
8 Experimenteller Teil 8.6 SPR-Expe
- Seite 179 und 180:
9 Literaturverzeichnis 9 Literaturv
- Seite 181 und 182:
9 Literaturverzeichnis [64] P. D. W
- Seite 183 und 184:
9 Literaturverzeichnis [133] T. Woh
- Seite 185 und 186:
10 Anhang 10.1 HPLC-offline-MS-Char
- Seite 187 und 188:
10.1.3 Peptid 71 (enzymatische Ring
- Seite 189 und 190:
10.1.5 SPR Peptide 92-97 H-Lys-His-
- Seite 191 und 192:
H-Lys-Gln-Pro-His-His-Gly-Glu-βAla
- Seite 193 und 194:
H-Lys-His-Pro-Gln-His-Gly-Glu-βAla
- Seite 195 und 196:
10.2 Massenspektren der fluoreszenz
- Seite 197 und 198:
10.3 MALDI-TOF-Massenspektren nach
- Seite 199 und 200:
Intens. 800 600 400 200 Intens. 200
- Seite 201 und 202:
Intens. x104 1.0 0.8 0.6 0.4 0.2 0.
- Seite 203 und 204:
Intens. 1000 800 600 400 200 Intens
- Seite 205 und 206:
Intens. 1000 800 600 400 200 0 Inte
- Seite 207 und 208:
Intens. 6000 4000 2000 0 Intens. 30
- Seite 209 und 210:
10.4 PTH-Val 10.4.1 1 H-NMR-Spektre
- Seite 211 und 212:
10 Anhang 197
- Seite 213 und 214:
Peptid 10 tR = 9,7 min Peptid 10 tR
- Seite 215 und 216:
Peptid 10 tR = 9,7 min Peptid 10 tR
- Seite 217 und 218:
10.6 SPR-Experimente Steady state a