- Page 3 and 4:
Física, conceptos y aplicaciones S
- Page 5 and 6:
Publisher: Javier Neyra Bravo Direc
- Page 7 and 8:
Para Jared Andrew Tippens y Elizabe
- Page 9 and 10:
Prefacio xiii Capítulo 1 Introducc
- Page 11 and 12:
Contenido 16.6 Dilatación superfic
- Page 13 and 14:
xii Contenido Capítulo 34 Reflexi
- Page 15 and 16:
xiv Prefacio res, pero se ha añadi
- Page 17 and 18:
xvi Prefacio esfuerzo por comprobar
- Page 20 and 21:
PARTE I Meca nica Introducción Cen
- Page 22 and 23:
¿Cómo estudiar física? 3 ¿Q ué
- Page 24 and 25:
¿Cómo estudiar física? 5 planifi
- Page 26 and 27:
2.1 Números con signo 7 3. Resolve
- Page 28 and 29:
2.1 Números con signo 9 Solución:
- Page 30 and 31:
2.2 Repaso de álgebra 11 Con frecu
- Page 32 and 33:
2.3 Exponentes y radicales (optativ
- Page 34 and 35:
2.4 Solución a ecuaciones cuadrát
- Page 36 and 37:
2.5 Notación científica 17 realiz
- Page 38 and 39:
2.7 Geometría 19 Figura 2.4 Gráfi
- Page 40 and 41:
2.7 Geometría 21 * a * ■■ g e
- Page 42 and 43:
2.8 Trigonometría dei triángulo r
- Page 44 and 45:
2.8 Trigonometría del triángulo r
- Page 46 and 47:
f s y 2 estimen y repaso Resumen El
- Page 48 and 49:
2.30. Un metal se dilata cuando se
- Page 50 and 51:
Sección 2.7 Geometría Nota: Si la
- Page 52 and 53:
vidiendo el resultado entre el radi
- Page 54 and 55:
3.1 Cantidades físicas 35 cuyas ma
- Page 56 and 57:
3.2 El Sistema Internacional 37 Uni
- Page 58 and 59:
3.4 Cifras significativas 39 Tabla
- Page 60 and 61:
3.5 Instrumentos de medición 41 re
- Page 62 and 63:
3.6 Conversión de unidades 43 A co
- Page 64 and 65:
3.7 Cantidades vectoriales y escala
- Page 66 and 67:
3.8 Suma o adición de vectores por
- Page 68 and 69:
3.9 Fuerza y vectores 49 2 0 Ib 20
- Page 70 and 71:
3.10 La fuerza resultante 51 Una co
- Page 72 and 73:
3.11 Trigonometría y vectores 53 q
- Page 74 and 75:
3.12 El m étodo de las componentes
- Page 76 and 77:
3.12 El m étodo de las componentes
- Page 78 and 79:
3.13 Notación de vectores unitario
- Page 80 and 81:
3.14 Resta o sustracción de vector
- Page 82 and 83:
Preguntas de repaso 3.1. Exprese la
- Page 84 and 85:
3.27. Se necesita un empuje vertica
- Page 86 and 87:
Preguntas para !a reflexión críti
- Page 88 and 89:
4.2 Segunda ley de Newton 69 los ef
- Page 90 and 91:
4.4 Equilibrio 71 j Fuerza del } ho
- Page 92 and 93:
4.5 Diagramas de cuerpo libre 73 40
- Page 94 and 95:
4.6 Solución de problemas de equil
- Page 96 and 97:
4.6 Solución de problemas de equil
- Page 98 and 99:
4.7 Fricción 79 WK A ^a 60( w, ^lv
- Page 100 and 101:
4.7 Fricción 81 Si se repite el ex
- Page 102 and 103:
4.7 Fricción 83 La fuerza que cont
- Page 104 and 105:
4.7 Fricción 85 La sustitución de
- Page 106 and 107:
Resumen En este capítulo hemos def
- Page 108 and 109:
4.4. Una sola cadena sostiene una p
- Page 110 and 111:
4.37. Calcule la tensión en el cab
- Page 112 and 113:
Momento de torsión y equilibrio ro
- Page 114 and 115:
5.2 El brazo de palanca 95 Figura 5
- Page 116 and 117:
5.3 M om ento de torsión 97 Se eje
- Page 118 and 119:
5.4 M om ento de to rsió n resulta
- Page 120 and 121:
5.5 E quilibrio 101 l l a r Conside
- Page 122 and 123:
5.5 E quilibrio 103 Solución: Cuan
- Page 124 and 125:
5.6 C entro de gravedad 105 Soluci
- Page 126 and 127:
Problemas Sección 5.2 El brazo de
- Page 128 and 129:
5.32. Una esfera de 40 N y una esfe
- Page 130 and 131:
Aceleración uniforme El guepardo e
- Page 132 and 133:
6.2 Aceleración 113 ve a lo largo
- Page 134 and 135:
6.3 M ovim iento uniform em ente ac
- Page 136 and 137:
6.5 Resolución de problem as de ac
- Page 138 and 139:
6.6 Convención de signos en proble
- Page 140 and 141:
6.7 Gravedad y cuerpos en caída li
- Page 142 and 143:
6.7 Gravedad y cuerpos en caída li
- Page 144 and 145:
6.7 Gravedad y cuerpos en caída li
- Page 146 and 147:
6.9 Proyección horizontal 127 Las
- Page 148 and 149:
6.10 El problema general de las tra
- Page 150 and 151:
6.10 El problem a general de las tr
- Page 152 and 153:
Preguntas de repaso 6.1. Explique c
- Page 154 and 155:
Sección 6.10 El problema más gene
- Page 156 and 157:
Segunda ley de Newton El transborda
- Page 158 and 159:
7.1 Segunda ley de N ew ton sobre e
- Page 160 and 161:
7.2 Relación entre peso y masa 141
- Page 162 and 163:
7.3 Aplicación de la segunda ley d
- Page 164 and 165:
7.4 Técnicas para resolver problem
- Page 166 and 167:
7.4 Técnicas para resolver problem
- Page 168 and 169:
7.4 Técnicas para resolver problem
- Page 170 and 171:
7.4 Técnicas para resolver problem
- Page 172 and 173:
Problemas Sección 7.1 Segunda ley
- Page 174 and 175:
7.35. El valor de ¿u, = 0.7 para n
- Page 176 and 177:
Trabajo, energía y potencia La Nin
- Page 178 and 179:
8.2 Trabajo resultante 159 Otro cas
- Page 180 and 181:
8.3 Energía 161 El peso W del bloq
- Page 182 and 183:
8.4 Trabajo y energía cinética 16
- Page 184 and 185:
8.5 Energía potencial 165 (a) (b)
- Page 186 and 187:
8.6 Conservación de la energía 16
- Page 188 and 189:
8.7 Energía y fuerzas de fricción
- Page 190 and 191:
8.8 Potencia 171 4. La energía tot
- Page 192 and 193:
Resumen En este capítulo se han ex
- Page 194 and 195:
alta del plano inclinado si fik = 0
- Page 196 and 197:
8.55. 8.56. 8.57. Un motor de 90 kW
- Page 198 and 199:
Impulso y cantidad de movimiento El
- Page 200 and 201:
9.1 Impulso y cantidad de movimient
- Page 202 and 203:
9.2 Ley de la conservación de la c
- Page 204 and 205:
9.3 Choques elásticos e inelástic
- Page 206 and 207:
9.3 Choques elásticos e inelástic
- Page 208 and 209:
9.3 Choques elásticos e inelástic
- Page 210 and 211:
Resumen En este capítulo hemos apr
- Page 212 and 213:
a 3 m /s y la pelota reduce su velo
- Page 214 and 215:
*9.50. Una masa de 2 kg se mueve ha
- Page 216 and 217:
10.2 Aceleración centrípeta 197 E
- Page 218 and 219:
10.2 Aceleración centrípeta 199 E
- Page 220 and 221:
10.4 Peralte de curvas 201 Dos masa
- Page 222 and 223:
10.4 Peralte de curvas 203 Figura 1
- Page 224 and 225:
10.6 Movimiento en un círculo vert
- Page 226 and 227:
10.7 Gravitación 207 Jí En la fig
- Page 228 and 229:
10.8 El campo gravitacional y el pe
- Page 230 and 231:
10.9 Satélites en órbitas circula
- Page 232 and 233:
10.10 Leyes de Kepler 213 Ejemplo 1
- Page 234 and 235:
Resumen Hemos definido el movimient
- Page 236 and 237:
Sección 10.4 Cálculo del peralte
- Page 238 and 239:
10.52. ¿Cuál debe ser la rapidez
- Page 240 and 241:
11.1 Desplazamiento angular 221 Obj
- Page 242 and 243:
11.2 Velocidad angular 223 Velocida
- Page 244 and 245:
11.3 Aceleración angular 225 Al ap
- Page 246 and 247:
11.5 Energía cinética rotacional;
- Page 248 and 249:
11.6 La segunda ley del movimiento
- Page 250 and 251:
11.6 La segunda ley del movimiento
- Page 252 and 253:
11.8 Rotación y traslación combin
- Page 254 and 255:
11.9 Cantidad de movimiento angular
- Page 256 and 257:
11.10 Conservación de la cantidad
- Page 258 and 259:
Preguntas de repaso 11.1. Elabore u
- Page 260 and 261:
nal de 80 N • m se opone a la rot
- Page 262 and 263:
11.59. Una fuerza constante de 200
- Page 264 and 265:
Máquinas simples Las máquinas sim
- Page 266 and 267:
12.2 Ventaja mecánica 247 Otra exp
- Page 268 and 269:
12.3 La palanca 249 La palanca Tal
- Page 270 and 271:
12.4 Aplicaciones del principio de
- Page 272 and 273:
12.5 La transmisión del momento de
- Page 274 and 275:
12.6 El plano inclinado 255 Engrane
- Page 276 and 277:
12.6 El plano inclinado 257 En casi
- Page 278 and 279:
12.7 Aplicaciones del plano inclina
- Page 280 and 281:
En el nivel alto, la rueda trasera
- Page 282 and 283:
12.29. ¿Cuál debe ser el ángulo
- Page 284 and 285:
Elasticidad El salto de bungee util
- Page 286 and 287:
13.1 Propiedades elásticas de la m
- Page 288 and 289:
13.2 Módulo de Young 269 donde I e
- Page 290 and 291:
13.3 Módulo de corte 271 13.3 Mód
- Page 292 and 293:
Tabla 13.3 M ódulos de volum en pa
- Page 294 and 295:
esumen y repaso Resumen En la indus
- Page 296 and 297:
sección transversal de un cilindro
- Page 298 and 299:
Movimiento armónico simple Un tram
- Page 300 and 301:
14.1 Movimiento periódico 281 part
- Page 302 and 303:
14.2 La segunda ley de Newton y la
- Page 304 and 305:
14.3 Trabajo y energía en el movim
- Page 306 and 307:
14.5 Velocidad en el movimiento arm
- Page 308 and 309:
14.6 Aceleración en el movimiento
- Page 310 and 311:
14.7 El periodo y la frecuencia 291
- Page 312 and 313:
14.8 El péndulo simple 293 El pén
- Page 314 and 315:
14.9 El péndulo de torsión 295 Cu
- Page 316 and 317:
Conceptos clave amplitud 281 consta
- Page 318 and 319:
magnitud y la dirección de la acel
- Page 320 and 321:
Los globos aerostáticos usan aire
- Page 322 and 323:
15.1 Densidad 303 m — 11.3 i Plom
- Page 324 and 325:
15.3 Presión del flu id o 305 Solu
- Page 326 and 327:
15.3 Presión del flu id o 307 Figu
- Page 328 and 329: 15.4 M edición de la presión 309
- Page 330 and 331: 15.6 Principio de Arquím edes 311
- Page 332 and 333: 15.6 Principio de Arquímedes 313 F
- Page 334 and 335: 15.7 Flujo de fluidos 315 Fluidos e
- Page 336 and 337: 15.8 Presión y velocidad 317 A par
- Page 338 and 339: 15.9 Ecuación de Bernoulli 319 v 2
- Page 340 and 341: 15.10 Aplicaciones de la ecuación
- Page 342 and 343: Resumen Hemos presentado aquí los
- Page 344 and 345: 15.18. Durante los ventarrones de a
- Page 346 and 347: fundidad. ¿Cuál sería el gasto d
- Page 348 and 349: Temperatura y dilatación La temper
- Page 350 and 351: 16.2 La medición de la temperatura
- Page 352 and 353: 16.2 La medición de la temperatura
- Page 354 and 355: 16.3 El termómetro de gas 335 Para
- Page 356 and 357: 16.4 La escala de temperatura absol
- Page 358 and 359: 16.5 Dilatación lineal 339 Figu ra
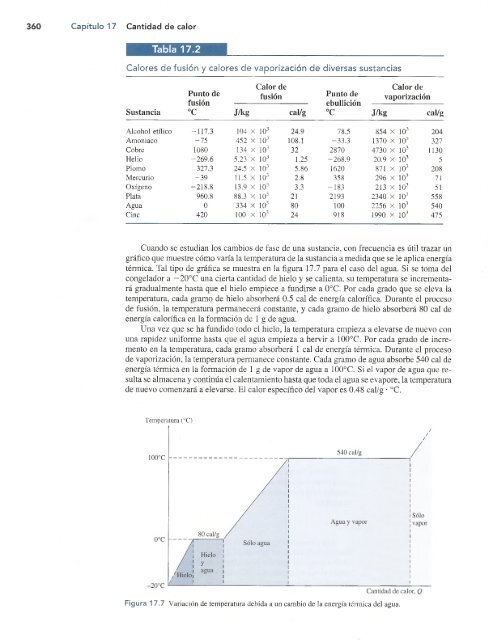
- Page 360 and 361: 16.6 Dilatación superficial 341 ha
- Page 362 and 363: 16.7 Dilatación volumétrica 343 T
- Page 364 and 365: 16.8 La dilatación anómala del ag
- Page 366 and 367: 16.5. ¿Hasta qué punto es eficaz
- Page 368 and 369: Termómetro Figura 16.17 Aparato pa
- Page 370 and 371: 17.2 La cantidad de calor 351 tempe
- Page 372 and 373: 17.3 Capacidad de calor específico
- Page 374 and 375: 17.4 La medición del calor 355 Tab
- Page 376 and 377: 17.4 La medición del calor 357 Fig
- Page 380 and 381: 17.5 Cambio de fase 361 Ejemplo 17.
- Page 382 and 383: 17.5 Cambio de fase 363 todo el hie
- Page 384 and 385: En este capítulo hemos estudiado l
- Page 386 and 387: 17.16. ¿Qué masa de agua que inic
- Page 388 and 389: Transferencia de calor La transfere
- Page 390 and 391: 18.2 Conducción 371 La fuente más
- Page 392 and 393: 18.2 Conducción 373 W/m ■K. Lueg
- Page 394 and 395: 18.4 Convección 375 dividido entre
- Page 396 and 397: 18.5 Radiación 377 Una masa de tie
- Page 398 and 399: Resumen y repaso -V El calor es la
- Page 400 and 401: 18.6. Una placa de acero de 20 mm d
- Page 402 and 403: Propiedades térmicas de la materia
- Page 404 and 405: 19.1 Gases ideales, ley de Boyle y
- Page 406 and 407: 19.3 Leyes generales de los gases 3
- Page 408 and 409: 19.4 Masa molecular y mol 389 Soluc
- Page 410 and 411: 19.5 La ley del gas ideal 391 se ob
- Page 412 and 413: 19.7 Vaporización 393 (a) A2 b2 Fi
- Page 414 and 415: 19.8 Presión de vapor 395 te como
- Page 416 and 417: 19.10 Humedad 397 Humedad El aire d
- Page 418 and 419: Resumen y repaso Es necesario conoc
- Page 420 and 421: 19.6. La presión absoluta de una m
- Page 422 and 423: Termodinámica Las máquinas térmi
- Page 424 and 425: 20.2 Función de la energía intern
- Page 426 and 427: 20.4 Procesos ¡sobáricos y el dia
- Page 428 and 429:
20.5 Caso general para la primera l
- Page 430 and 431:
20.7 Procesos isocóricos 411 Figur
- Page 432 and 433:
20.9 Segunda ley de la termodinámi
- Page 434 and 435:
20.11 La eficiencia de una máquina
- Page 436 and 437:
20.12 Máquinas de combustión inte
- Page 438 and 439:
20.13 Refrigeración 419 Depósito
- Page 440 and 441:
La termodinámica es la ciencia que
- Page 442 and 443:
*20.9. A una presión constante de
- Page 444 and 445:
20.43. Una máquina de Carnot tiene
- Page 446 and 447:
21.2 Tipos de ondas 427 La energía
- Page 448 and 449:
21.4 Movimiento ondulatorio periód
- Page 450 and 451:
21.5 Energía de una onda periódic
- Page 452 and 453:
21.6 Principio de superposición 43
- Page 454 and 455:
21.8 Frecuencias características 4
- Page 456 and 457:
Hemos investigado el movimiento ond
- Page 458 and 459:
21.6. Si el alambre del problema 21
- Page 460 and 461:
Sonido Durante siglos, las ondas so
- Page 462 and 463:
22.2 La rapidez del sonido 443 Comp
- Page 464 and 465:
22.3 Vibración de columnas de aire
- Page 466 and 467:
22.3 Vibración de columnas de aire
- Page 468 and 469:
22.5 Ondas sonoras audibles 449 _p
- Page 470 and 471:
22.5 Ondas sonoras audibles 451 Tab
- Page 472 and 473:
22.7 Interferencia y pulsaciones 45
- Page 474 and 475:
22.8 El efecto Doppler 455 Figura 2
- Page 476 and 477:
22.8 El efecto Doppler 457 Ejemplo
- Page 478 and 479:
arefacción 443 resonancia 448 soni
- Page 480 and 481:
22.23. Una fuente sonora de 3.0 W s
- Page 482 and 483:
% PARTE Electricidad, magnetismo y
- Page 484 and 485:
23.1 La carga eléctrica 465 Figura
- Page 486 and 487:
23.4 El electroscopio de hojas de o
- Page 488 and 489:
23.6 Carga por inducción 469 Un ra
- Page 490 and 491:
23.7 Ley de Coulomb 471 ■►F F F
- Page 492 and 493:
23.7 Ley de Coulomb 473 Estrategia
- Page 494 and 495:
Resumen La electrostática es la ci
- Page 496 and 497:
23.23. Una carga de 5 ¿aC se local
- Page 498 and 499:
24.1 Concepto de campo 479 Si en re
- Page 500 and 501:
24.1 Concepto de campo 481 Figura 2
- Page 502 and 503:
24.2 Cálculo de la intensidad del
- Page 504 and 505:
24.3 Líneas del campo eléctrico 4
- Page 506 and 507:
24.4 Ley de Gauss 487 Partiendo de
- Page 508 and 509:
24.5 Aplicaciones de la ley de Gaus
- Page 510 and 511:
24.5 Aplicaciones de la ley de Gaus
- Page 512 and 513:
24.7. Justifique el enunciado sigui
- Page 514 and 515:
*24.33. Use la ley de Gauss para de
- Page 516 and 517:
Objetivos Cuando term ine de estudi
- Page 518 and 519:
25.2 Cálculo de la energía potenc
- Page 520 and 521:
25.3 Potencial eléctrico 501 Soluc
- Page 522 and 523:
25.3 Potencial eléctrico 503 Un va
- Page 524 and 525:
25.4 Diferencia de potencial 505 Pu
- Page 526 and 527:
25.6 El electrón volt 507 carga op
- Page 528 and 529:
25.3. Cite un ejemplo en el cual la
- Page 530 and 531:
*25.36. A cierta distancia de una c
- Page 532 and 533:
26.1 Limitaciones al cargar un cond
- Page 534 and 535:
26.2 El condensador 515 E 6!:s ¿Cu
- Page 536 and 537:
26.3 Cálculo de la capacitancia 51
- Page 538 and 539:
26.4 Constante dieléctrica; permit
- Page 540 and 541:
26.4 Constante dieléctrica; permit
- Page 542 and 543:
26.5 Condensadores en paralelo y en
- Page 544 and 545:
26.5 Condensadores en paralelo y en
- Page 546 and 547:
Resumen El almacenamiento de cargas
- Page 548 and 549:
26.3. ¿Cuál sería el radio de un
- Page 550 and 551:
lámina de porcelana (K = 6) entre
- Page 552 and 553:
27.1 El movimiento de la carga elé
- Page 554 and 555:
La dirección de la corriente eléc
- Page 556 and 557:
27.4 Ley de Ohm; resistencia 537 M
- Page 558 and 559:
27.5 Potencia eléctrica y pérdida
- Page 560 and 561:
27.7 Coeficiente de temperatura de
- Page 562 and 563:
27.8 Superconductividad 543 Figura
- Page 564 and 565:
Resumen En este capítulo presentam
- Page 566 and 567:
*27.27. Los devanados de cobre de u
- Page 568 and 569:
28.1 Circuitos simples; resistores
- Page 570 and 571:
28.2 Resistores en paralelo 551 Las
- Page 572 and 573:
28.2 Resistores en paralelo 553 Fig
- Page 574 and 575:
28.4 Medición de la resistencia in
- Page 576 and 577:
28.6 Leyes de Kirchhoff 557 I = ^ (
- Page 578 and 579:
28.6 Leyes de Kirchhoff 559 Resulta
- Page 580 and 581:
28.6 Leyes de Kirchhoff 561 Ahora s
- Page 582 and 583:
28.3. ¿Qué significa la diferenci
- Page 584 and 585:
2 O. - w - 20 V —il— 3 n — M-
- Page 586 and 587:
Los instrumentos para obtener imág
- Page 588 and 589:
29.1 Magnetismo 569 Un descubrimien
- Page 590 and 591:
29.4 Densidad de flujo y permeabili
- Page 592 and 593:
29.4 Densidad de flujo y permeabili
- Page 594 and 595:
29.6 Fuerza sobre una carga en movi
- Page 596 and 597:
29.7 Fuerza sobre un conductor por
- Page 598 and 599:
29.8 Campo magnético de un conduct
- Page 600 and 601:
29.10 Histéresis 581 un solenoide
- Page 602 and 603:
Resumen Hemos visto que ios campos
- Page 604 and 605:
Sección 29.6 La fuerza sobre una c
- Page 606 and 607:
ocasionada por ambos alambres? (Sug
- Page 608 and 609:
Fuerza y momentos de torsión en un
- Page 610 and 611:
30.1 Fuerza y momento de torsión e
- Page 612 and 613:
30.4 El voltímetro de cd 593 Figur
- Page 614 and 615:
30.6 El motor de cd 595 Un galvanó
- Page 616 and 617:
Resumen El momento magnético de la
- Page 618 and 619:
tir ese aparato en un instrumento c
- Page 620 and 621:
Inducción electromagnética Las im
- Page 622 and 623:
31.1 Ley de Faraday 603 Figura 3 1
- Page 624 and 625:
31.2 Fem inducida por un conductor
- Page 626 and 627:
31.4 El generador de ca 607 Movimie
- Page 628 and 629:
31.4 El generador de ca 609 Figura
- Page 630 and 631:
31.6 Fuerza contraelectromotriz en
- Page 632 and 633:
31.7 Tipos de motores 613 A rm adu
- Page 634 and 635:
31.8 El transformador 615 Se establ
- Page 636 and 637:
Resumen La inducción electromagné
- Page 638 and 639:
31.4. El flujo magnético que enlaz
- Page 640 and 641:
(a) Figura 31.1 8 Aplicación de la
- Page 642 and 643:
Objetivos Cuando term ine de estudi
- Page 644 and 645:
32.1 El condensador 625 En un circu
- Page 646 and 647:
32.2 El inductor 627 flujo AO/A?, o
- Page 648 and 649:
32.4 Relación de fase en circuitos
- Page 650 and 651:
32.5 Reactancia 631 +S, i Corriente
- Page 652 and 653:
32.6 Circuitos en serie de ca 633 O
- Page 654 and 655:
32.8 El fa cto r de potencia 635 El
- Page 656 and 657:
- 3 Conceptos clave ángulo de fase
- Page 658 and 659:
32.19. Un condensador tiene un rég
- Page 660 and 661:
inductancia (véase el problema 32.
- Page 662 and 663:
33.1 ¿Qué es la luz? 643 Una barr
- Page 664 and 665:
33.2 Propagación de la luz 645 La
- Page 666 and 667:
33.3 Espectro electromagnético 647
- Page 668 and 669:
33.5 Rayos de luz y sombras 649 Rad
- Page 670 and 671:
33.6 Flujo lum inoso 651 Figura 33.
- Page 672 and 673:
33.7 Intensidad luminosa 653 Ejempl
- Page 674 and 675:
33.8 Iluminación 655 Figura 33.17
- Page 676 and 677:
Resumen La investigación sobre la
- Page 678 and 679:
33.3. Un radiador de microondas que
- Page 680 and 681:
Reflexión y espejos La luz láser
- Page 682 and 683:
34.1 Las leyes de la reflexión 663
- Page 684 and 685:
34.3 Espejos esféricos 665 Una ima
- Page 686 and 687:
34.4 Imágenes form adas por espejo
- Page 688 and 689:
34.5 La ecuación del espejo 669 ~
- Page 690 and 691:
34.6 Amplificación 671 En el grues
- Page 692 and 693:
34.7 Aberración esférica 673 de l
- Page 694 and 695:
Preguntas de repaso Comente esta af
- Page 696 and 697:
no invertida de 5 cm de altura, ¿c
- Page 698 and 699:
35.1 índice de refracción 679 N F
- Page 700 and 701:
35.2 Las leyes de refracción 681 (
- Page 702 and 703:
35.3 Longitud de onda y refracción
- Page 704 and 705:
35.5 Refracción interna total 685
- Page 706 and 707:
35.6 Fibras ópticas y aplicaciones
- Page 708 and 709:
¿Es lo mismo ver que creer? 35.7
- Page 710 and 711:
35.8 Profundidad aparente 691 Usand
- Page 712 and 713:
35.5. ¿Los objetos de densidad óp
- Page 714 and 715:
*35.35. La luz que pasa a través d
- Page 716 and 717:
36.1 Lentes sim ples 697 36.1 Lente
- Page 718 and 719:
36.2 Longitud focal y la ecuación
- Page 720 and 721:
36.3 Formación de imágenes median
- Page 722 and 723:
36.4 La ecuación de las lentes y l
- Page 724 and 725:
36.5 Combinaciones de lentes 705 La
- Page 726 and 727:
36.ó El microscopio compuesto 707
- Page 728 and 729:
36.8 Aberraciones de las lentes 709
- Page 730 and 731:
36.7. Un objeto se desplaza desde l
- Page 732 and 733:
Preguntas para la reflexión críti
- Page 734 and 735:
37.2 Experimento de Young: interfer
- Page 736 and 737:
37.2 Experimento de Young: interfer
- Page 738 and 739:
37.3 La red de difracción 719 Solu
- Page 740 and 741:
37.4 Poder de resolución de instru
- Page 742 and 743:
37.4 Poder de resolución de instru
- Page 744 and 745:
37.5 Polarización 725 Figura 3 7.1
- Page 746 and 747:
tensidad I del haz transmitido por
- Page 748:
Espejo móvil X *37.31. Las luces p
- Page 751 and 752:
732 Capítulo 38 La física moderna
- Page 753 and 754:
734 Capítulo 38 La física moderna
- Page 755 and 756:
736 Capítulo 38 La física moderna
- Page 757 and 758:
738 Capítulo 38 La física moderna
- Page 759 and 760:
740 Capítulo 38 La física moderna
- Page 761 and 762:
742 Capítulo 38 La física moderna
- Page 763 and 764:
744 Capítulo 38 La física moderna
- Page 765 and 766:
746 Capítulo 38 La física moderna
- Page 767 and 768:
748 Capítulo 38 La física moderna
- Page 769 and 770:
750 Capítulo 38 La física moderna
- Page 771 and 772:
• i i m í 't V.J h /! Resumen y
- Page 773 and 774:
38.7. ¿Qué masa se requiere para
- Page 775 and 776:
*38.50. En el experimento fotoeléc
- Page 777 and 778:
758 Capítulo 39 La física nuclear
- Page 779 and 780:
O < > < > VA IVA < CQ 1. He 4.0026
- Page 781 and 782:
Pesos atómicos internacionales (ba
- Page 783 and 784:
764 Capítulo 39 La física nuclear
- Page 785 and 786:
766 Capítulo 39 La física nuclear
- Page 787 and 788:
768 Capítulo 39 La física nuclear
- Page 789 and 790:
770 Capítulo 39 La física nuclear
- Page 791 and 792:
772 Capítulo 39 La física nuclear
- Page 793 and 794:
774 Capítulo 39 La física nuclear
- Page 795 and 796:
776 Capítulo 39 La física nuclear
- Page 797 and 798:
W m Resumen y repaso h y á Resumen
- Page 799 and 800:
Problemas Tome como referencia la t
- Page 801 and 802:
782 Capítulo 39 Resumen y repaso
- Page 803 and 804:
Figura 3. Trace la raíz. I-ííit:
- Page 805 and 806:
EOAT: EDftT [ [3 6 . , 10Q. ] [45.,
- Page 807 and 808:
Figura 3. Definiciones y variables.
- Page 809 and 810:
obtiene la altura máxima sobre és
- Page 811 and 812:
1-2 índice bats de béisbol con ho
- Page 813 and 814:
1-4 índice conservación de masa-e
- Page 815 and 816:
I-é índice espectrómetro, 743 es
- Page 817 and 818:
1-8 índice sublimación de sólido
- Page 819 and 820:
1-10 índice máquina de combustió
- Page 821 and 822:
1-12 índice onda, movimiento de, 4
- Page 823 and 824:
1-14 índice refracción de la luz,
- Page 825:
1-16 índice transformador, 614-16