- Page 3 and 4:
FÍSICA para ciencias e ingeniería
- Page 5:
Dedicamos este libro a nuestras esp
- Page 9 and 10:
Acerca de los autores Prefacio xiii
- Page 11:
Contenido ix PARTE 3 TERMODINÁMICA
- Page 15 and 16:
Al escribir esta séptima edición
- Page 17 and 18:
Prefacio xv TAREAS EN LÍNEA Ahora
- Page 19 and 20:
Prefacio xvii Problemas de diseño
- Page 21 and 22:
Prefacio xix CIFRAS SIGNIFICATIVAS
- Page 23:
Prefacio xxi pel, Portland State Un
- Page 26 and 27:
xxiv Al estudiante Use las caracter
- Page 29 and 30:
Mecánica La física, fundamental e
- Page 31 and 32:
Sección 1.1 Estándares de longitu
- Page 33 and 34:
Sección 1.1 Estándares de longitu
- Page 35 and 36:
Sección 1.3 Análisis dimensional
- Page 37 and 38:
Los exponentes de L y T deben ser l
- Page 39 and 40:
1.5 Estimaciones y cálculos de ord
- Page 41 and 42:
Resumen 13 En este libro la mayorí
- Page 43 and 44:
Problemas 15 planas a lo largo de l
- Page 45 and 46:
Problemas 17 44. Problema de repaso
- Page 47 and 48:
En las carreras de dragsters un con
- Page 49 and 50:
A partir de los datos de la tabla 2
- Page 51 and 52:
Sección 2.2 Velocidad y rapidez in
- Page 53 and 54:
Sección 2.2 Velocidad y rapidez in
- Page 55 and 56:
Sección 2.4 Aceleración 27 consta
- Page 57 and 58:
Para ayudar con esta discusión de
- Page 59 and 60:
Sección 2.5 Diagramas de movimient
- Page 61 and 62:
Sección 2.6 La partícula bajo ace
- Page 63 and 64:
obtener una solución. Recuerde que
- Page 65 and 66:
Sección 2.7 Objetos en caída libr
- Page 67 and 68:
Sección 2.8 Ecuaciones cinemática
- Page 69 and 70:
Sección 2.8 Ecuaciones cinemática
- Page 71 and 72:
Resumen 43 Resumen DEFINICIONES Cua
- Page 73 and 74:
Preguntas 45 a) b) c) Figura P2.7 P
- Page 75 and 76:
Problemas 47 la aceleración promed
- Page 77 and 78:
Problemas 49 un haz de luz infrarro
- Page 79 and 80:
Problemas 51 acelera hacia arriba a
- Page 81 and 82:
Los controles en la cabina de una a
- Page 83 and 84:
Sección 3.3 Algunas propiedades de
- Page 85 and 86:
Sección 3.3 Algunas propiedades de
- Page 87 and 88:
Sección 3.4 Componentes de un vect
- Page 89 and 90:
3.4 Componentes de un vector y vect
- Page 91 and 92:
Sección 3.4 Componentes de un vect
- Page 93 and 94:
Problemas 65 dad que apunta desde e
- Page 95 and 96:
Problemas 67 2.00 m al noreste y 1.
- Page 97 and 98:
Problemas 69 este valor mínimo? d)
- Page 99 and 100:
Expulsión de lava de una erupción
- Page 101 and 102:
Sección 4.1 Vectores de posición,
- Page 103 and 104:
Sección 4.2 Movimiento en dos dime
- Page 105 and 106:
Sección 4.3 Movimiento de proyecti
- Page 107 and 108:
Sección 4.3 Movimiento de proyecti
- Page 109 and 110:
Sección 4.3 Movimiento de proyecti
- Page 111 and 112:
Sección 4.3 Movimiento de proyecti
- Page 113 and 114:
Sección 4.4 Partícula en movimien
- Page 115 and 116:
En el movimiento circular uniforme,
- Page 117 and 118:
Sección 4.6 Velocidad y aceleraci
- Page 119 and 120:
Preguntas 91 CONCEPTOS Y PRINCIPIOS
- Page 121 and 122:
Problemas 93 Problemas 1. Un motoc
- Page 123 and 124:
Problemas 95 termine la rapidez de
- Page 125 and 126:
Problemas 97 del intervalo de tiemp
- Page 127 and 128:
Respuestas a las preguntas rápidas
- Page 129 and 130:
Sección 5.1 Concepto de fuerza 101
- Page 131 and 132:
Sección 5.3 Masa 103 el disco y el
- Page 133 and 134:
Sección 5.4 Segunda ley de Newton
- Page 135 and 136:
Sección 5.6 Tercera ley de Newton
- Page 137 and 138:
Sección 5.7 Algunas aplicaciones d
- Page 139 and 140:
Sección 5.7 Algunas aplicaciones d
- Page 141 and 142:
Sección 5.7 Algunas aplicaciones d
- Page 143 and 144:
Finalizar La aceleración conocida
- Page 145 and 146:
Sección 5.7 Algunas aplicaciones d
- Page 147 and 148:
Finalizar El bloque acelera hacia a
- Page 149 and 150:
Sección 5.8 Fuerzas de fricción 1
- Page 151 and 152:
Sección 5.8 Fuerzas de fricción 1
- Page 153 and 154:
Preguntas 125 MODELO DE ANÁLISIS P
- Page 155 and 156:
Preguntas 127 bloque más pequeño
- Page 157 and 158:
Problemas 129 n y P. c) Compare sus
- Page 159 and 160:
Problemas 131 31. En el sistema que
- Page 161 and 162:
Problemas 133 10.0° con la horizon
- Page 163 and 164:
Problemas 135 Cojín h Fuerza del
- Page 165 and 166:
Los pasajeros en una montaña rusa
- Page 167 and 168:
Sección 6.1 Segunda ley de Newton
- Page 169 and 170:
Sección 6.1 Segunda ley de Newton
- Page 171 and 172:
B) Resolver para la fuerza que ejer
- Page 173 and 174:
Sección 6.3 Movimiento en marcos a
- Page 175 and 176:
actúan hacia la izquierda. b) La p
- Page 177 and 178:
Sección 6.4 Movimiento en presenci
- Page 179 and 180:
Sección 6.4 Movimiento en presenci
- Page 181 and 182:
Sección 6..4 Movimiento en presenc
- Page 183 and 184:
Problemas 155 en este punto? b) De
- Page 185 and 186:
Problemas 157 más los pasajeros es
- Page 187 and 188:
Problemas 159 que las prendas se se
- Page 189 and 190:
Problemas 161 57. Un automóvil rec
- Page 191 and 192:
En una granja de viento, el aire en
- Page 193 and 194:
Sección 7.2 Trabajo invertido por
- Page 195 and 196:
Sección 7.3 Producto escalar de do
- Page 197 and 198:
Sección 7.4 Trabajo consumido por
- Page 199 and 200:
Sección 7.4 Trabajo consumido por
- Page 201 and 202:
Sección 7.4 Trabajo consumido por
- Page 203 and 204:
TABLA 7.1 Sección 7.5 Energía cin
- Page 205 and 206:
Respuesta Si se jala más fuerte, e
- Page 207 and 208:
este enunciado es verdadero en gene
- Page 209 and 210:
el resorte no esté deformado (x 0
- Page 211 and 212:
Sección 7.8 Correspondencia entre
- Page 213 and 214:
Sección 7.9 Diagramas de energía
- Page 215 and 216:
Resumen 187 Resumen DEFINICIONES Co
- Page 217 and 218:
Problemas 189 24. Para limpiarlas,
- Page 219 and 220:
Problemas 191 26. Exprese las unida
- Page 221 and 222:
Problemas 193 b) Demuestre que la e
- Page 223 and 224:
A medida que un esquiador se desliz
- Page 225 and 226:
yen llenar el tanque de su automóv
- Page 227 and 228:
En el capítulo 7 se definió la su
- Page 229 and 230:
Sección 8.2 El sistema aislado 201
- Page 231 and 232:
Sección 8.2 El sistema aislado 203
- Page 233 and 234:
A cada lado de la ecuación 8.11 se
- Page 235 and 236:
Sección 8.3 Situaciones que incluy
- Page 237 and 238:
Respuesta En este caso, el valor de
- Page 239 and 240:
Sección 8.4 Cambios en energía me
- Page 241 and 242:
Sección 8.5 Potencia 213 distancia
- Page 243 and 244:
Sección 8.5 Potencia 215 SOLUCIÓN
- Page 245 and 246:
Preguntas 217 Preguntas O indica pr
- Page 247 and 248:
Problemas 219 comparación con la l
- Page 249 and 250:
Problemas 221 c) el intervalo de po
- Page 251 and 252:
Problemas 223 a) ¿Qué trabajo inv
- Page 253 and 254:
Problemas 225 20.0 kg 40.0 Figura P
- Page 255 and 256:
Una bola de boliche en movimiento t
- Page 257 and 258:
Sección 9.1 Cantidad de movimiento
- Page 259 and 260:
Sección 9.1 Cantidad de movimiento
- Page 261 and 262:
Sección 9.2 Impulso y cantidad de
- Page 263 and 264:
Sección 9.3 Colisiones en una dime
- Page 265 and 266:
ligera que inicialmente está en re
- Page 267 and 268:
SOLUCIÓN Sección 9.3 Colisiones e
- Page 269 and 270:
Sección 9.3 Colisiones en una dime
- Page 271 and 272:
Sección 9.4 Colisiones en dos dime
- Page 273 and 274:
Sección 9.5 El centro de masa 245
- Page 275 and 276:
Sección 9.5 El centro de masa 247
- Page 277 and 278:
Sección 9.5 El centro de masa 249
- Page 279 and 280:
Es decir, la fuerza externa neta en
- Page 281 and 282:
Sección 9.7 Sistemas deformables 2
- Page 283 and 284:
Sección 9.8 Propulsión de cohetes
- Page 285 and 286:
Sección 9.8 Propulsión de cohetes
- Page 287 and 288:
Preguntas 259 Preguntas O indica pr
- Page 289 and 290:
Problemas 261 colisión frontal a 6
- Page 291 and 292:
Problemas 263 largo de una direcci
- Page 293 and 294:
Problemas 265 del sistema deslizado
- Page 295 and 296:
Problemas 267 y v 1A x 67. Una bala
- Page 297 and 298:
El pasatiempo malayo gasing es el g
- Page 299 and 300:
Sección 10.1 Posición, velocidad
- Page 301 and 302:
Sección 10.3 Cantidades angulares
- Page 303 and 304:
Sección 10.3 Cantidades angulares
- Page 305 and 306:
Sección 10.4 Energía cinética ro
- Page 307 and 308:
m/V, donde es la densidad del obje
- Page 309 and 310:
Sección 10.5 Cálculo de momentos
- Page 311 and 312:
Sección 10.7 Objeto rígido bajo u
- Page 313 and 314:
del momento de inercia de todo el m
- Page 315 and 316:
Sección 10.8 Consideraciones energ
- Page 317 and 318:
TABLA 10.3 Ecuaciones útiles en mo
- Page 319 and 320:
Sección 10.9 Movimiento de rodamie
- Page 321 and 322:
Sección 10.9 Movimiento de rodamie
- Page 323 and 324:
Sección 10.9 Movimiento de rodamie
- Page 325 and 326:
Resumen 297 CONCEPTOS Y PRINCIPIOS
- Page 327 and 328:
Problemas 299 21. O Un balón de ba
- Page 329 and 330:
Problemas 301 el número de revoluc
- Page 331 and 332:
Problemas 303 30.0 a O 12.0 N b 10.
- Page 333 and 334:
Problemas 305 50. La cabeza de una
- Page 335 and 336:
Problemas 307 64. Un eje gira a 65.
- Page 337 and 338:
Problemas 309 sobre la parte baja d
- Page 339 and 340:
Una clavadista competitiva experime
- Page 341 and 342:
Sección 11.1 Producto vectorial y
- Page 343 and 344:
Sección 11.2 Cantidad de movimient
- Page 345 and 346:
Sección 11.2 Cantidad de movimient
- Page 347 and 348:
Sección 11.3 Cantidad de movimient
- Page 349 and 350:
Sección 11.4 El sistema aislado: c
- Page 351 and 352:
Sección 11.4 El sistema aislado: c
- Page 353 and 354:
Sección 11.4 El sistema aislado: c
- Page 355 and 356:
Sección 11.5 El movimiento de giro
- Page 357 and 358:
Preguntas 329 Preguntas O indica pr
- Page 359 and 360:
Problemas 331 15. Una partícula de
- Page 361 and 362:
Problemas 333 inicio, las cuentas s
- Page 363 and 364:
Problemas 335 Sol? La cantidad de m
- Page 365 and 366:
La Roca Equilibrada en el Arches Na
- Page 367 and 368:
de momento de torsión pero no en e
- Page 369 and 370:
Sección 12.3 Ejemplos de objetos r
- Page 371 and 372:
Sección 12.3 Ejemplos de objetos r
- Page 373 and 374:
Sección 12.3 Ejemplos de objetos r
- Page 375 and 376:
Sección 12.4 Propiedades elástica
- Page 377 and 378:
Sección 12.4 Propiedades elástica
- Page 379 and 380:
Sección 12.4 Propiedades elástica
- Page 381 and 382:
Problemas 353 5. O Considere el obj
- Page 383 and 384:
Problemas 355 1 500 kg 45 Figura
- Page 385 and 386:
Problemas 357 28. Problema de repas
- Page 387 and 388:
Problemas 359 la barra debe ser ver
- Page 389 and 390:
Problemas 361 v máx gRd Para reduc
- Page 391 and 392:
Sección 13.1 Ley de Newton de grav
- Page 393 and 394:
Sección 13.2 Aceleración en caíd
- Page 395 and 396:
Sección 13.3 Las leyes de Kepler y
- Page 397 and 398:
Sección 13.3 Las leyes de Kepler y
- Page 399 and 400:
Sección 13.3 Las leyes de Kepler y
- Page 401 and 402:
Para ejemplificar cómo funciona el
- Page 403 and 404:
SOLUCIÓN Sección 13.6 Consideraci
- Page 405 and 406:
Sección 13.6 Consideraciones energ
- Page 407 and 408:
Sección 13.6 Consideraciones energ
- Page 409 and 410:
Preguntas 381 Las leyes de Kepler d
- Page 411 and 412:
Problemas 383 8. Un estudiante pro
- Page 413 and 414:
Problemas 385 27. Un sistema consi
- Page 415 and 416:
Problemas 387 tendría en su lugar
- Page 417 and 418:
En el Mar Muerto, un lago entre Jor
- Page 419 and 420:
Sección 14.2 Variación de la pres
- Page 421 and 422:
Sección 14.2 Variación de la pres
- Page 423 and 424:
Sección 14.4 Fuerzas de flotación
- Page 425 and 426:
Sección 14.4 Fuerzas de flotación
- Page 427 and 428:
Sección 14.5 Dinámica de fluidos
- Page 429 and 430:
Sección 14.5 Dinámica de fluidos
- Page 431 and 432:
Si divide cada término entre la po
- Page 433 and 434:
Sección 14.7 Otras aplicaciones de
- Page 435 and 436:
Preguntas 407 Preguntas O indica pr
- Page 437 and 438:
Problemas 409 5. El resorte del me
- Page 439 and 440:
96 98 100 102 104 Problemas 411 23.
- Page 441 and 442:
Problemas 413 Bernoulli para determ
- Page 443 and 444:
Problemas 415 requerida para separa
- Page 445 and 446:
Esta nueva parte del texto inicia c
- Page 447 and 448:
Sección 15.1 Movimiento de un obje
- Page 449 and 450:
Sección 15.2 Partícula en movimie
- Page 451 and 452:
Sección 15.2 Partícula en movimie
- Page 453 and 454:
Sección 15.2 Partícula en movimie
- Page 455 and 456:
Sección 15.3 Energía del oscilado
- Page 457 and 458:
Sección 15.4 Comparación de movim
- Page 459 and 460:
Sección 15.4 Comparación de movim
- Page 461 and 462:
Sección 15.5 El péndulo 433 TABLA
- Page 463 and 464:
Sección 15.5 El péndulo 435 EJEMP
- Page 465 and 466:
Sección 15.7 Oscilaciones forzadas
- Page 467 and 468:
Resumen 439 Resumen CONCEPTOS Y PRI
- Page 469 and 470:
Problemas 441 explique en los mismo
- Page 471 and 472:
Problemas 443 A 23. Mientras viaj
- Page 473 and 474:
Problemas 445 48. Un objeto de masa
- Page 475 and 476:
Problemas 447 64. Cuando un bloque
- Page 477 and 478:
Las olas combinan propiedades de la
- Page 479 and 480:
Sección 16.1 Propagación de una p
- Page 481 and 482:
Sección 16.1 Propagación de una p
- Page 483 and 484:
Sección 16.2 El modelo de onda pro
- Page 485 and 486:
B) Determine la constante de fase
- Page 487 and 488:
Sección 16.3 La rapidez de ondas e
- Page 489 and 490:
Sección 16.4 Reflexión y transmis
- Page 491 and 492:
Sección 16.5 Rapidez de transferen
- Page 493 and 494:
¿Qué pasaría si? ¿Y si la cuerd
- Page 495 and 496:
Preguntas 467 CONCEPTOS Y PRINCIPIO
- Page 497 and 498:
Problemas 469 6. Cierta cuerda uni
- Page 499 and 500:
Problemas 471 fango con densidad si
- Page 501 and 502:
Problemas 473 y la rapidez de propa
- Page 503 and 504:
Sección 17.1 Rapidez de ondas sono
- Page 505 and 506:
donde la amplitud de presión P má
- Page 507 and 508:
Sección 17.3 Intensidad de ondas s
- Page 509 and 510:
Sección 17.3 Intensidad de ondas s
- Page 511 and 512:
lanca es el umbral del dolor. En es
- Page 513 and 514:
Sección 17.4 El efecto Doppler 485
- Page 515 and 516:
Sección 17.4 El efecto Doppler 487
- Page 517 and 518:
Sección 17.5 Grabación de sonido
- Page 519 and 520:
Convierta cada uno de estos bits a
- Page 521 and 522:
Problemas 493 cambia. d) Disminuye
- Page 523 and 524:
Problemas 495 resurrecti - o - - -
- Page 525 and 526:
Problemas 497 bido a electrones de
- Page 527 and 528:
Respuestas a las preguntas rápidas
- Page 529 and 530:
18.1 Sobreposición e interferencia
- Page 531 and 532:
Sección 18.1 Sobreposición e inte
- Page 533 and 534:
Sección 18.2 Ondas estacionarias 5
- Page 535 and 536:
dividuales y las curvas cafés son
- Page 537 and 538:
Sección 18.3 Ondas estacionarias e
- Page 539 and 540:
Sección 18.3 Ondas estacionarias e
- Page 541 and 542:
Sección 18.5 Ondas estacionarias e
- Page 543 and 544:
Sección 18.5 Ondas estacionarias e
- Page 545 and 546: Sección 18.7 Batimientos: interfer
- Page 547 and 548: Sección 18.8 Patrones de ondas no
- Page 549 and 550: Sección 18.8 Patrones de ondas no
- Page 551 and 552: Preguntas 523 Preguntas O indica pr
- Page 553 and 554: Problemas 525 9. Dos ondas sinusoid
- Page 555 and 556: Problemas 527 cercanos donde la amp
- Page 557 and 558: Problemas 529 a) Hallar la rapidez
- Page 559 and 560: Ahora conviene dirigir la atención
- Page 561 and 562: Sección 19.1 Temperatura y ley cer
- Page 563 and 564: Sección 19.3 Termómetro de gas a
- Page 565 and 566: Sección 19.4 Expansión térmica d
- Page 567 and 568: TABLA 19.1 Coeficientes de expansi
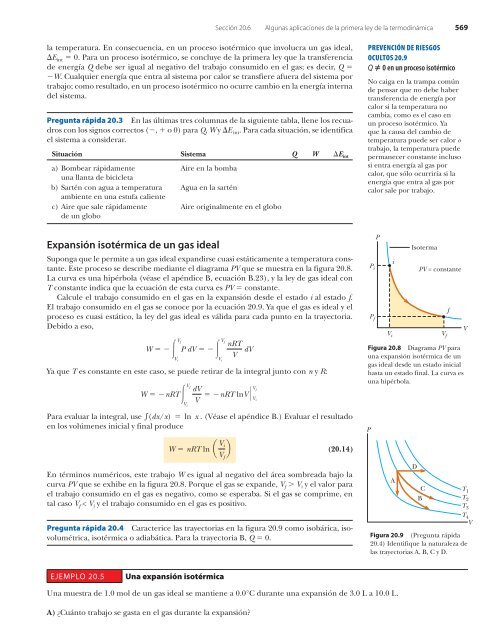
- Page 569 and 570: Sección 19.4 Expansión térmica d
- Page 571 and 572: Estas observaciones se resumen medi
- Page 573 and 574: Preguntas 545 Resumen DEFINICIONES
- Page 575 and 576: Problemas 547 temperatura es de 20.
- Page 577 and 578: Problemas 549 T i A h T i T el pis
- Page 579 and 580: Problemas 551 ratura absoluta. b)
- Page 581 and 582: En esta fotografía del lago Bow, e
- Page 583 and 584: Figura 20.1 Experimento de Joule pa
- Page 585 and 586: TABLA 20.1 Sección 20.2 Calor espe
- Page 587 and 588: Sección 20.2 Calor específico y c
- Page 589 and 590: TABLA 20.2 Calores latentes de fusi
- Page 591 and 592: vuelve explosiva pues de inmediato
- Page 593 and 594: Sección 20.4 Trabajo y calor en pr
- Page 595: Sección 20.6 Algunas aplicaciones
- Page 599 and 600: Sección 20.6 Algunas aplicaciones
- Page 601 and 602: Sección 20.7 Mecanismos de transfe
- Page 603 and 604: utilizados en la construcción por
- Page 605 and 606: Resumen 577 net sAe 1T 4 T 0 4 2 (2
- Page 607 and 608: Preguntas 579 Preguntas O indica pr
- Page 609 and 610: Problemas 581 Figura P20.8 9. Un c
- Page 611 and 612: Problemas 583 36. En la figura P20.
- Page 613 and 614: Problemas 585 59. Un recipiente de
- Page 615 and 616: Los perros no tienen glándulas sud
- Page 617 and 618: Ahora, por la tercera ley de Newton
- Page 619 and 620: Sección 21.1 Modelo molecular de u
- Page 621 and 622: centro de masa. Esto no debería so
- Page 623 and 624: En el caso de sólidos y líquidos
- Page 625 and 626: Sección 21.4 Equipartición de la
- Page 627 and 628: diatómicos. Mientras más grados d
- Page 629 and 630: Sección 21.5 Distribución de magn
- Page 631 and 632: que tienen suficiente energía para
- Page 633 and 634: Preguntas 605 Resumen CONCEPTOS Y P
- Page 635 and 636: Problemas 607 Nota: Puede usar los
- Page 637 and 638: Problemas 609 donde n 0 es la densi
- Page 639 and 640: Respuestas a las preguntas rápidas
- Page 641 and 642: Sección 22.1 Máquinas térmicas y
- Page 643 and 644: Sección 22.2 Bombas de calor y ref
- Page 645 and 646: Sección 22.3 Procesos reversibles
- Page 647 and 648:
Sección 22.4 La máquina de Carnot
- Page 649 and 650:
Sección 22.4 La máquina de Carnot
- Page 651 and 652:
3. En el proceso B C la combustió
- Page 653 and 654:
Sección 22.6 Entropía 625 La caus
- Page 655 and 656:
Sección 22.7 Cambios de entropía
- Page 657 and 658:
Sección 22.8 Entropía de escala m
- Page 659 and 660:
Sección 22.8 Entropía de escala m
- Page 661 and 662:
Preguntas 633 CONCEPTOS Y PRINCIPIO
- Page 663 and 664:
Problemas 635 15. O Considere los p
- Page 665 and 666:
Problemas 637 23. ¿Cuánto trabajo
- Page 667 and 668:
Problemas 639 5.00°C. a) Calcule l
- Page 669 and 670:
TABLA A.1 Factores de conversión L
- Page 671 and 672:
Apéndice A Tablas A-3 TABLA A.2 S
- Page 673 and 674:
B.2 Álgebra A-5 Cuando se dividen
- Page 675 and 676:
B.2 Álgebra A-7 Factorización Las
- Page 677 and 678:
B.3 Geometría A-9 Ejercicios Resue
- Page 679 and 680:
B.4 Trigonometría A-11 del triáng
- Page 681 and 682:
B.6 Cálculo diferencial A-13 e x 1
- Page 683 and 684:
d dx a g h b d dx 1 gh 1 2 g d dx 1
- Page 685 and 686:
8.7 Cálculo integral A-17 Una inte
- Page 687 and 688:
8.7 Cálculo integral A-19 TABLA B.
- Page 689 and 690:
Para cálculos complicados muchas i
- Page 691 and 692:
Apéndice C Tabla periódica de los
- Page 693 and 694:
CAPÍTULO 1 1. 5.52 10 3 kg/m 3 ,
- Page 695 and 696:
Respuestas a problemas con número
- Page 697 and 698:
Respuestas a problemas con número
- Page 699 and 700:
Respuestas a problemas con número
- Page 701 and 702:
Respuestas a problemas con número
- Page 703 and 704:
Respuestas a problemas con número
- Page 705 and 706:
Nota de ubicación: negrilla indica
- Page 707 and 708:
Índice I-3 Conductividad térmica
- Page 709 and 710:
Índice I-5 Frecuencia angular () d
- Page 711 and 712:
Índice I-7 Mecánica estadística,
- Page 713 and 714:
Índice I-9 rapidez de, 475, 475, 4
- Page 715:
Índice I-11 gas a volumen constant
- Page 718 and 719:
Algunas constantes físicas Cantida
- Page 720 and 721:
Abreviaturas estándar y símbolos