Chemická termodynamika II
Chemická termodynamika II
Chemická termodynamika II
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
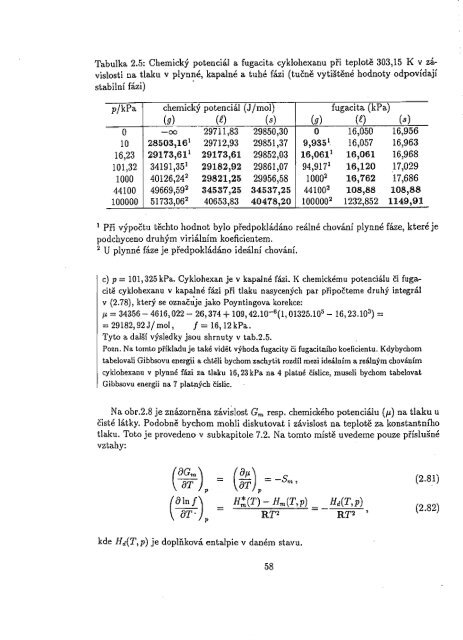
Tabulka 2.5: Chemický potenciál a fugacita cyklohexanu při teplotě 303,15 K v závislosti<br />
na tlaku v plynné, kapalné a tuhé fázi (tučně vytištěné hodnoty odpovídají<br />
stabilní fázi) .<br />
pjkPa chemický potenciál (Jjmol) fugacita (kPa)<br />
(g) (l) (8) (g) (f) (s)<br />
O -00 29711,83 29850,30<br />
16,050 16,956<br />
10 28503,16 °<br />
29712,93 29851,37 9,935 1 16,057 16,963<br />
16,23 29173,61 1 29173,61 29852,03 16,061 1 16,061 16,968<br />
101,32 34191,35 1 29182,92 29861,07 94,917 1 16,120 17,029<br />
1000 40126,24 2 29821,25 29956,58 1000 2 16,762 17,686<br />
44100 49669,59 2 34537,25 34537,25 44100 2 108,88 108,88<br />
100000 51733,06 2 40653,83 40478,20 100000 2 1232,852 1149,91<br />
1 Při výpočtu těchto hodnot bylo předpokládáno reálné chování plynné fáze, které je<br />
podchyceno druhým viriálním koeficientem.<br />
2 U plynné fáze je předpokládánoideální chování.<br />
c) p = 101,325 kPa. Cyklohexan je v kapalné fázi. K chemickému potencíálu či fuga.<br />
cítě cyklohexanu v kapalné fázi při tlaku nasycených pa.r připočteme druhý integrál<br />
v (2.78), který se ozna.čůje jako Poyntingova. korekce:<br />
ll- = 34356 - 4616,022 - 26,374 +109,42.10- 6 (1,01325.10 5 - 16,23.10 3 ) =<br />
=29182, 92J/mol, f = 16, 12 kPa..<br />
Tyto a další výsledky jsou shrnuty v tab.2.5.<br />
Pozn. Na tomto příkladuje také vidět výhoda fugacity či fugacitního koeficientu. Kdybychom<br />
tabelovali Gibbsovu energii a chtěli bychom zachytit rozdíl mezi ideálním a reálným chováním<br />
cyklohexanu v plynné fázi za tlaku 16,23 kPa na 4 platné číslice, museli bychom tabelovat<br />
Gibbsovu energii na 7 platných číslic.<br />
Na obr.2.8 je znázorněnazávislost G m resp. chemického potenciálu (p,) na tlaku u<br />
čisté látky. Podobně bychom mohli diskutovat i závislost na teplotě za konstantního<br />
tlaku. Toto je provedeno v subkapitole 7.2. Na tomto místě uvedeme pouze příslušné<br />
vztahy:<br />
(2.81)<br />
(2.82)<br />
kde HJ.(T,p) je doplňkováentalpie v daném stavu.<br />
58