- Page 1 and 2:
‹çindekiler iii ‹çindekiler
- Page 3 and 4:
‹çindekiler v Gerçek Gazlar›n
- Page 5 and 6:
‹çindekiler vii KOMPLEKS REAKS
- Page 7 and 8:
Önsöz ix Önsöz Bu kitap, ö¤re
- Page 9 and 10:
Gazlar G‹R‹fi Fizikokimya, bir
- Page 11 and 12:
1. Ünite - Gazlar 5 Burada bas›n
- Page 13 and 14:
1. Ünite - Gazlar 7 fiekil 1.1 Boy
- Page 15 and 16:
1. Ünite - Gazlar 9 Pistonlu bir k
- Page 17 and 18:
1. Ünite - Gazlar 11 298,15 K’de
- Page 19 and 20:
1. Ünite - Gazlar 13 fiekil 1.3 A
- Page 21 and 22:
1. Ünite - Gazlar 15 Moleküller a
- Page 23 and 24:
1. Ünite - Gazlar 17 1 PV = RT = N
- Page 25 and 26:
1. Ünite - Gazlar 19 eflitli¤i il
- Page 27 and 28:
1. Ünite - Gazlar 21 Graham yasas
- Page 29 and 30:
1. Ünite - Gazlar 23 aç›klanabi
- Page 31 and 32:
1. Ünite - Gazlar 25 deki h›zl
- Page 33 and 34:
Gaz a (atm L 2 mol -2 ) b (L mol -1
- Page 35 and 36:
1. Ünite - Gazlar 29 Özet Maddeni
- Page 37 and 38:
1. Ünite - Gazlar 31 Kendimizi S
- Page 39 and 40:
1. Ünite - Gazlar 33 Yararlan›la
- Page 41 and 42:
Termodinami¤in 1. Yasas› G‹R
- Page 43 and 44:
2. Ünite - Termodinami¤in 1. Yasa
- Page 45 and 46:
2. Ünite - Termodinami¤in 1. Yasa
- Page 47 and 48:
2. Ünite - Termodinami¤in 1. Yasa
- Page 49 and 50:
2. Ünite - Termodinami¤in 1. Yasa
- Page 51 and 52:
2. Ünite - Termodinami¤in 1. Yasa
- Page 53 and 54:
2. Ünite - Termodinami¤in 1. Yasa
- Page 55 and 56:
2. Ünite - Termodinami¤in 1. Yasa
- Page 57 and 58:
2. Ünite - Termodinami¤in 1. Yasa
- Page 59 and 60:
2. Ünite - Termodinami¤in 1. Yasa
- Page 61 and 62:
2. Ünite - Termodinami¤in 1. Yasa
- Page 63 and 64:
2. Ünite - Termodinami¤in 1. Yasa
- Page 65 and 66:
2. Ünite - Termodinami¤in 1. Yasa
- Page 67 and 68:
2. Ünite - Termodinami¤in 1. Yasa
- Page 69 and 70:
2. Ünite - Termodinami¤in 1. Yasa
- Page 72 and 73:
3F‹Z‹KOK‹MYA Amaçlar›m›z
- Page 74 and 75:
68 Fizikokimya Entropi: Bir sistemi
- Page 76 and 77:
70 Fizikokimya fiekil 3.1 Carnot ç
- Page 78 and 79:
72 Fizikokimya Böylece arka arkaya
- Page 80 and 81:
74 Fizikokimya w= − PdV =−TdS (
- Page 82 and 83:
76 Fizikokimya S = FTV ( , ) ⎛ S
- Page 84 and 85:
78 Fizikokimya bulunur. ‹fllem te
- Page 86 and 87:
80 Fizikokimya Buharlaflma entalpil
- Page 88 and 89:
82 Fizikokimya Çözüm: 1. Basamak
- Page 90 and 91:
84 Fizikokimya Özet Do¤ada bir ç
- Page 92 and 93:
86 Fizikokimya Kendimizi S›nayal
- Page 94 and 95:
4F‹Z‹KOK‹MYA Amaçlar›m›z
- Page 96 and 97:
90 Fizikokimya REAKS‹YON ‹Ç EN
- Page 98 and 99:
92 Fizikokimya SIRA S‹ZDE DÜfiÜ
- Page 100 and 101:
94 Fizikokimya olarak yaz›l›r.
- Page 102 and 103:
96 Fizikokimya Çizelgelerde verile
- Page 104 and 105:
98 Fizikokimya ÖRNEK 4.8: C 10 H 1
- Page 106 and 107:
100 Fizikokimya s›ras›ndaki sta
- Page 108 and 109:
102 Fizikokimya ÖRNEK 4.11: CaCl 2
- Page 110 and 111:
4. Ünite - Termokimya 103 iyonlar
- Page 112 and 113:
4. Ünite - Termokimya 105 Kendimiz
- Page 114 and 115:
4. Ünite - Termokimya 107 Yararlan
- Page 116 and 117:
Serbest Enerji G‹R‹fi Ünite 2
- Page 118 and 119:
5. Ünite - Serbest Enerji Sabit ba
- Page 120 and 121:
5. Ünite - Serbest Enerji 113 PV
- Page 122 and 123: 5. Ünite - Serbest Enerji 115 Efli
- Page 124 and 125: 5. Ünite - Serbest Enerji 117 ⎛
- Page 126 and 127: 5. Ünite - Serbest Enerji 119 ‹d
- Page 128 and 129: 1 mol gerçek gaz için, ( Gm ) 2 P
- Page 130 and 131: 5. Ünite - Serbest Enerji 123 273
- Page 132 and 133: 5. Ünite - Serbest Enerji 125 Öze
- Page 134 and 135: 5. Ünite - Serbest Enerji 127 Kend
- Page 137 and 138: 6F‹Z‹KOK‹MYA Amaçlar›m›z
- Page 139 and 140: 132 Fizikokimya ÖRNEK 6.1: H 2 (g)
- Page 141 and 142: 134 Fizikokimya Dengedeki bir siste
- Page 143 and 144: 136 Fizikokimya Çözüm: Verilenle
- Page 145 and 146: 138 Fizikokimya Deriflime ba¤l›
- Page 147 and 148: 140 Fizikokimya ÖRNEK 6.8: F 2 (g)
- Page 149 and 150: 142 Fizikokimya x N2 + x H2 = 1 - x
- Page 151 and 152: 144 Fizikokimya fleklinde yaz›l
- Page 153 and 154: 146 Fizikokimya ∆H = nC p dT efli
- Page 155 and 156: 148 Fizikokimya eflitli¤i elde edi
- Page 157 and 158: 150 Fizikokimya Özet Dengedeki bir
- Page 159 and 160: 152 Fizikokimya Kendimizi S›nayal
- Page 161 and 162: 154 Fizikokimya S›ra Sizde 5 K p
- Page 163 and 164: 7F‹Z‹KOK‹MYA Amaçlar›m›z
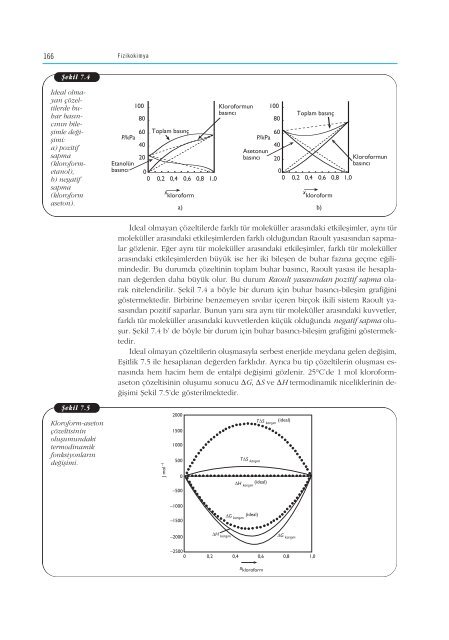
- Page 165 and 166: 158 Fizikokimya Gazlar kar›flt›
- Page 167 and 168: 160 Fizikokimya ⎛ ∆G Karışma
- Page 169 and 170: 162 Fizikokimya fiekil 7.2 ‹deal
- Page 171: 164 Fizikokimya G m,A (s) = G m,A (
- Page 175 and 176: 168 Fizikokimya x N 2 xO 2 PN 0, 78
- Page 177 and 178: 170 Fizikokimya V = nAVA + nBVB for
- Page 179 and 180: 172 Fizikokimya fleklinde yaz›lab
- Page 181 and 182: 174 Fizikokimya fiekil 7.8 Saf s›
- Page 183 and 184: 176 Fizikokimya olur. x B =0 için
- Page 185 and 186: 178 Fizikokimya SIRA S‹ZDE DÜfi
- Page 187 and 188: 180 Fizikokimya ÖRNEK 7.12: Bir ar
- Page 189 and 190: 182 Fizikokimya Kendimizi S›nayal
- Page 191 and 192: 184 Fizikokimya S›ra Sizde 2 ‹d
- Page 193 and 194: 8F‹Z‹KOK‹MYA Amaçlar›m›z
- Page 195 and 196: 188 Fizikokimya n a A (P,T ) = nb A
- Page 197 and 198: 190 Fizikokimya fiekil 8.1 Suyun fa
- Page 199 and 200: 192 Fizikokimya fiimdi birbiriyle a
- Page 201 and 202: 194 Fizikokimya ‹K‹ B‹LEfiENL
- Page 203 and 204: 196 Fizikokimya fiekil 8.3 lar›n
- Page 205 and 206: 198 Fizikokimya n 1 = 0,674 n 2 bul
- Page 207 and 208: 200 Fizikokimya sini bas›nç olar
- Page 209 and 210: 202 Fizikokimya fiekil 8.7 Peritekt
- Page 211 and 212: 204 Fizikokimya ‹ki Bileflenli Si
- Page 213 and 214: 206 Fizikokimya fiekil 8.10 ‹deal
- Page 215 and 216: 208 Fizikokimya mum zenginlefltirme
- Page 217 and 218: 210 Fizikokimya fiekil 8.14 Üç bi
- Page 219 and 220: 212 Fizikokimya Özet Bir sistemde
- Page 221 and 222: 214 Fizikokimya Kendimizi S›nayal
- Page 223 and 224:
9F‹Z‹KOK‹MYA Amaçlar›m›z
- Page 225 and 226:
218 Fizikokimya aksiyon enzim katal
- Page 227 and 228:
220 Fizikokimya Herhangi bir reaksi
- Page 229 and 230:
222 Fizikokimya SIRA S‹ZDE DÜfi
- Page 231 and 232:
224 Fizikokimya ⎡ ⎣⎢ A⎤ ⎦
- Page 233 and 234:
226 Fizikokimya Çözüm: Önce ver
- Page 235 and 236:
228 Fizikokimya SIRA S‹ZDE DÜfi
- Page 237 and 238:
230 Fizikokimya fiekil 9.5 [A]’ya
- Page 239 and 240:
232 Fizikokimya SIRA S‹ZDE DÜfi
- Page 241 and 242:
234 Fizikokimya 2 d ⎡NO ⎤ k ⎡
- Page 243 and 244:
236 Fizikokimya eflitli¤i elde edi
- Page 245 and 246:
238 Fizikokimya K‹MYASAL K‹NET
- Page 247 and 248:
240 Fizikokimya SIRA S‹ZDE dN −
- Page 249 and 250:
242 Fizikokimya enerji, kompleksi o
- Page 251 and 252:
244 Fizikokimya Eflitlikte yer alan
- Page 253 and 254:
246 Fizikokimya için, bu iki molek
- Page 255 and 256:
248 Fizikokimya Kendimizi S›nayal
- Page 257 and 258:
F‹Z‹KOK‹MYA 10 Amaçlar›m
- Page 259 and 260:
252 Fizikokimya Burada t orant› s
- Page 261 and 262:
254 Fizikokimya Zay›f Elektrolitl
- Page 263 and 264:
256 Fizikokimya SIRA S‹ZDE DÜfi
- Page 265 and 266:
258 Fizikokimya SIRA S‹ZDE DÜfi
- Page 267 and 268:
260 Fizikokimya ‹yon hareketlili
- Page 269 and 270:
262 Fizikokimya ‹yon hareketlilik
- Page 271 and 272:
264 Fizikokimya Çizelge 10.1 Baz
- Page 273 and 274:
266 Fizikokimya ‹yonlar›n kimya
- Page 275 and 276:
268 Fizikokimya ÖRNEK 10.10: 25°C
- Page 277 and 278:
270 Fizikokimya Kendimizi S›nayal
- Page 279 and 280:
272 Fizikokimya S›ra Sizde Yan›
- Page 281 and 282:
F‹Z‹KOK‹MYA 11 Amaçlar›m
- Page 283 and 284:
276 Fizikokimya anotta ise yükselt
- Page 285 and 286:
278 Fizikokimya dengesi tuz köprü
- Page 287 and 288:
280 Fizikokimya Amalgam Elektrotlar
- Page 289 and 290:
282 Fizikokimya Hücre reaksiyonu,
- Page 291 and 292:
284 Fizikokimya SIRA S‹ZDE DÜfi
- Page 293 and 294:
286 Fizikokimya b. Serbest enerji d
- Page 295 and 296:
288 Fizikokimya SIRA S‹ZDE DÜfi
- Page 297 and 298:
290 Fizikokimya Gaz elektrotlar ile
- Page 299 and 300:
292 Fizikokimya ÖRNEK 11.6: Pt ; H
- Page 301 and 302:
294 Fizikokimya Çizelge 11.1’den
- Page 303 and 304:
296 Fizikokimya ÖRNEK 11.9: Pt(k)
- Page 305 and 306:
298 Fizikokimya Özet Elektrokimyas
- Page 307 and 308:
300 Fizikokimya Kendimizi S›nayal
- Page 309 and 310:
302 Fizikokimya S›ra Sizde 5 Yar
- Page 311 and 312:
F‹Z‹KOK‹MYA 12 Amaçlar›m
- Page 313 and 314:
306 Fizikokimya fiekil 12.1 S›v
- Page 315 and 316:
308 Fizikokimya mdamla = Vd = 4 3 r
- Page 317 and 318:
310 Fizikokimya ÖRNEK 12.3: 25°C
- Page 319 and 320:
312 Fizikokimya meden, (T-6) s›ca
- Page 321 and 322:
314 Fizikokimya Çizelge 12.1 Kollo
- Page 323 and 324:
316 Fizikokimya fiekil 12.5 Kolloid
- Page 325 and 326:
318 Fizikokimya Arayüzeye kadar i
- Page 327 and 328:
320 Fizikokimya kaplad›¤›nda b
- Page 329 and 330:
322 Fizikokimya Adsorpsiyon izoterm
- Page 331 and 332:
324 Fizikokimya 16 15 14 13 12 11 1
- Page 333 and 334:
326 Fizikokimya Gaz adsorpsiyonu i
- Page 335 and 336:
328 Fizikokimya Özet Herhangi iki
- Page 337 and 338:
330 Fizikokimya Kendimizi S›nayal
- Page 339 and 340:
332 Fizikokimya Ek
- Page 341 and 342:
334 Fizikokimya Enerji 4, 5, 8, 10,
- Page 343 and 344:
336 Fizikokimya N Nernst eflitli¤i