Periodoncia.Eley.6a.Ed
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
14 <strong>Periodoncia</strong><br />
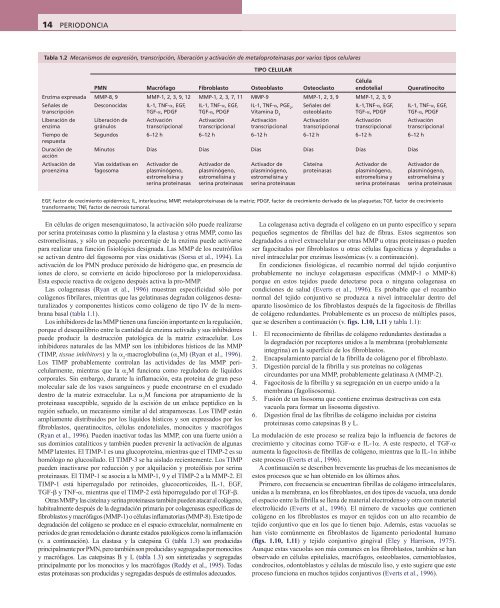
Tabla 1.2 Mecanismos de expresión, transcripción, liberación y activación de metaloproteinasas por varios tipos celulares<br />
TIPO CELULAR<br />
PMN Macrófago Fibroblasto Osteoblasto Osteoclasto<br />
Célula<br />
endotelial<br />
Enzima expresada MMP-8, 9 MMP-1, 2, 3, 9, 12 MMP-1, 2, 3, 7, 11 MMP-9 MMP-1, 2, 3, 9 MMP-1, 2, 3, 9<br />
Señales de<br />
transcripción<br />
Liberación de<br />
enzima<br />
Tiempo de<br />
respuesta<br />
Duración de<br />
acción<br />
Activación de<br />
proenzima<br />
Desconocidas<br />
Liberación de<br />
gránulos<br />
IL-1, TNF-a, EGF,<br />
TGF-a, PDGF<br />
Activación<br />
transcripcional<br />
IL-1, TNF-a, EGF,<br />
TGF-a, PDGF<br />
Activación<br />
transcripcional<br />
IL-1, TNF-a, PGE 2<br />
,<br />
Vitamina D 3<br />
Activación<br />
transcripcional<br />
Señales del<br />
osteoblasto<br />
Activación<br />
transcripcional<br />
IL-1,TNF-a, EGF,<br />
TGF-a, PDGF<br />
Activación<br />
transcripcional<br />
Segundos 6–12 h 6–12 h 6–12 h 6–12 h 6–12 h 6–12 h<br />
Minutos Días Días Días Días Días Días<br />
Vías oxidativas en<br />
fagosoma<br />
Activador de<br />
plasminógeno,<br />
estromelisina y<br />
serina proteinasas<br />
Activador de<br />
plasminógeno,<br />
estromelisina y<br />
serina proteinasas<br />
Activador de<br />
plasminógeno,<br />
estromelisina y<br />
serina proteinasas<br />
Cisteína<br />
proteinasas<br />
Activador de<br />
plasminógeno,<br />
estromelisina y<br />
serina proteinasas<br />
Queratinocito<br />
IL-1, TNF-a, EGF,<br />
TGF-a, PDGF<br />
Activación<br />
transcripcional<br />
Activador de<br />
plasminógeno,<br />
estromelisina y<br />
serina proteinasas<br />
EGF, factor de crecimiento epidérmico; IL, interleucina; MMP, metaloproteinasas de la matriz; PDGF, factor de crecimiento derivado de las plaquetas; TGF, factor de crecimiento<br />
transformante; TNF, factor de necrosis tumoral.<br />
En células de origen mesenquimatoso, la activación sólo puede realizarse<br />
por serina proteinasas como la plasmina y la elastasa y otras MMP, como las<br />
estromelisinas, y sólo un pequeño porcentaje de la enzima puede activarse<br />
para realizar una función fisiológica designada. Las MMP de los neutrófilos<br />
se activan dentro del fagosoma por vías oxidativas (Sorsa et al., 1994). La<br />
activación de los PMN produce peróxido de hidrógeno que, en presencia de<br />
iones de cloro, se convierte en ácido hipocloroso por la mieloperoxidasa.<br />
Esta especie reactiva de oxígeno después activa la pro-MMP.<br />
Las colagenasas (Ryan et al., 1996) muestran especificidad sólo por<br />
colágenos fibrilares, mientras que las gelatinasas degradan colágenos desnaturalizados<br />
y componentes hísticos como colágeno de tipo IV de la membrana<br />
basal (tabla 1.1).<br />
Los inhibidores de las MMP tienen una función importante en la regulación,<br />
porque el desequilibrio entre la cantidad de enzima activada y sus inhibidores<br />
puede producir la destrucción patológica de la matriz extracelular. Los<br />
inhibidores naturales de las MMP son los inhibidores hísticos de las MMP<br />
(TIMP, tissue inhibitors) y la a 2<br />
-macroglobulina (a 2<br />
M) (Ryan et al., 1996).<br />
Los TIMP probablemente controlan las actividades de las MMP pericelularmente,<br />
mientras que la a 2<br />
M funciona como reguladora de líquidos<br />
corporales. Sin embargo, durante la inflamación, esta proteína de gran peso<br />
molecular sale de los vasos sanguíneos y puede encontrarse en el exudado<br />
dentro de la matriz extracelular. La a 2<br />
M funciona por atrapamiento de la<br />
proteinasa susceptible, seguido de la escisión de un enlace peptídico en la<br />
región señuelo, un mecanismo similar al del atrapamoscas. Los TIMP están<br />
ampliamente distribuidos por los líquidos hísticos y son expresados por los<br />
fibroblastos, queratinocitos, células endoteliales, monocitos y macrófagos<br />
(Ryan et al., 1996). Pueden inactivar todas las MMP, con una fuerte unión a<br />
sus dominios catalíticos y también pueden prevenir la activación de algunas<br />
MMP latentes. El TIMP-1 es una glucoproteína, mientras que el TIMP-2 es su<br />
homólogo no glucosilado. El TIMP-3 se ha aislado recientemente. Los TIMP<br />
pueden inactivarse por reducción y por alquilación y proteólisis por serina<br />
proteinasas. El TIMP-1 se asocia a la MMP-1, 9 y el TIMP-2 a la MMP-2. El<br />
TIMP-1 está hiperregulado por retinoides, glucocorticoides, IL-1, EGF,<br />
TGF-b y TNF-a, mientras que el TIMP-2 está hiporregulado por el TGF-b.<br />
Otras MMP y las cisteína y serina proteinasas también pueden atacar al colágeno,<br />
habitualmente después de la degradación primaria por colagenasas específicas de<br />
fibroblastos y macrófagos (MMP-1) o células inflamatorias (MMP-8). Este tipo de<br />
degradación del colágeno se produce en el espacio extracelular, normalmente en<br />
períodos de gran remodelación o durante estados patológicos como la inflamación<br />
(v. a continuación). La elastasa y la catepsina G (tabla 1.3) son producidas<br />
principalmente por PMN, pero también son producidas y segregadas por monocitos<br />
y macrófagos. Las catepsinas B y L (tabla 1.3) son sintetizadas y segregadas<br />
principalmente por los monocitos y los macrófagos (Reddy et al., 1995). Todas<br />
estas proteinasas son producidas y segregadas después de estímulos adecuados.<br />
La colagenasa activa degrada el colágeno en un punto específico y separa<br />
pequeños segmentos de fibrillas del haz de fibras. Estos segmentos son<br />
degradados a nivel extracelular por otras MMP u otras proteinasas o pueden<br />
ser fagocitados por fibroblastos u otras células fagocíticas y degradadas a<br />
nivel intracelular por enzimas lisosómicas (v. a continuación).<br />
En condiciones fisiológicas, el recambio normal del tejido conjuntivo<br />
probablemente no incluye colagenasas específicas (MMP-1 o MMP-8)<br />
porque en estos tejidos puede detectarse poca o ninguna colagenasa en<br />
condiciones de salud (Everts et al., 1996). Es probable que el recambio<br />
normal del tejido conjuntivo se produzca a nivel intracelular dentro del<br />
aparato lisosómico de los fibroblastos después de la fagocitosis de fibrillas<br />
de colágeno redundantes. Probablemente es un proceso de múltiples pasos,<br />
que se describen a continuación (v. figs. 1.10, 1.11 y tabla 1.1):<br />
1. El reconocimiento de fibrillas de colágeno redundantes destinadas a<br />
la degradación por receptores unidos a la membrana (probablemente<br />
integrina) en la superficie de los fibroblastos.<br />
2. Encapsulamiento parcial de la fibrilla de colágeno por el fibroblasto.<br />
3. Digestión parcial de la fibrilla y sus proteínas no colágenas<br />
circundantes por una MMP, probablemente gelatinasa A (MMP-2).<br />
4. Fagocitosis de la fibrilla y su segregación en un cuerpo unido a la<br />
membrana (fagolisosoma).<br />
5. Fusión de un lisosoma que contiene enzimas destructivas con esta<br />
vacuola para formar un lisosoma digestivo.<br />
6. Digestión final de las fibrillas de colágeno incluidas por cisteína<br />
proteinasas como catepsinas B y L.<br />
La modulación de este proceso se realiza bajo la influencia de factores de<br />
crecimiento y citocinas como TGF-a e IL-1a. A este respecto, el TGF-a<br />
aumenta la fagocitosis de fibrillas de colágeno, mientras que la IL-1a inhibe<br />
este proceso (Everts et al., 1996).<br />
A continuación se describen brevemente las pruebas de los mecanismos de<br />
estos procesos que se han obtenido en los últimos años.<br />
Primero, con frecuencia se encuentran fibrillas de colágeno intracelulares,<br />
unidas a la membrana, en los fibroblastos, en dos tipos de vacuola, una donde<br />
el espacio entre la fibrilla se llena de material electrodenso y otra con material<br />
electrolúcido (Everts et al., 1996). El número de vacuolas que contienen<br />
colágeno en los fibroblastos es mayor en tejidos con un alto recambio de<br />
tejido conjuntivo que en los que lo tienen bajo. Además, estas vacuolas se<br />
han visto comúnmente en fibroblastos de ligamento periodontal humano<br />
(figs. 1.10, 1.11) y tejido conjuntivo gingival (Eley y Harrison, 1975).<br />
Aunque estas vacuolas son más comunes en los fibroblastos, también se han<br />
observado en células epiteliales, macrófagos, osteoblastos, cementoblastos,<br />
condrocitos, odontoblastos y células de músculo liso, y esto sugiere que este<br />
proceso funciona en muchos tejidos conjuntivos (Everts et al., 1996).