178 QUADERNO ARSIA 5/2004La conoscenza del tasso di crescita di una coltura(che dipende dalle caratteristiche genetiche, ambientalie colturali) è fondamentale per sceglierecorrettamene la soluzione nutritiva da somministrarealla coltura, in particolare <strong>nel</strong> caso di piante contasso di crescita elevato. In pratica più rapida è lacrescita <strong>delle</strong> piante, tanto maggiori sono le esigenzenutritive e più facilmente possono insorgeredegli squilibri nutrizionali. Invece, <strong>nel</strong> caso di colturea tasso di crescita limitato la specificità dellacomposizione della soluzione nutritiva è menoimportante e l’uso di ricette standard trova maggiorefondamento. Si pensi, ad esempio, agliimpianti per l’idrocoltura di piante ornamentali invaso, dove sono allevate insieme, con un’unicasoluzione, centinaia di specie diverse, dai ficus aicactus, confidando <strong>nel</strong>le minori esigenze <strong>delle</strong> piantedeterminate dal loro ridotto tasso di crescita.Il problema consiste, quindi, non tanto <strong>nel</strong>l’individuareuna formula nutritiva ottimale per lediverse specie, quanto <strong>nel</strong> determinare le quantitàdi nutrienti che devono essere somministrate allepiante <strong>nel</strong>le diverse fasi di sviluppo in funzione<strong>delle</strong> condizioni colturali e ambientali. La radiazionee la temperatura hanno, ad esempio, una notevoleinfluenza sull’accrescimento della pianta; pertanto,durante le stagioni più favorevoli alla crescita,per la coltura devono essere disponibili maggioriquantità di acqua e di nutrienti. In tab. 4sono state, comunque, riportate le composizioni dialcune soluzioni nutritive riportate in letteraturaper colture ornamentali; <strong>nel</strong>la stessa tabella è statoriportato anche il range di concentrazione dei microelementi.Nella scelta della soluzione nutritiva da applicarealle piante è importante considerare anche latolleranza della coltura alla salinità.Calcolo della composizionedella soluzione nutritivaDi seguito si illustra l’approccio metodologicorelativo al calcolo della composizione di una soluzionenutritiva, mentre <strong>nel</strong> CD allegato al manualeè contenuto un foglio elettronico, SOL-NUTRI,per la formulazione di una soluzione nutritiva, sviluppatodal dott. Luca Incrocci dell’Università diPisa <strong>nel</strong>l’ambito di un progetto di ricerca (IDRO-SUB) finanziato dall’ENEA (le istruzioni per l’uso diSOL-NUTRI sono riportate <strong>nel</strong>l’Appendice E).Prima di passare al calcolo vero e proprio dellasoluzione nutritiva, è necessaria una valutazione dellaqualità dell’acqua irrigua: pH, concentrazione di carbonatie bicarbonati (alcalinità), EC e la concentrazionedi ioni nutritivi e non (ad esempio, sodio).Nella pratica, per attuare la fertirrigazione, vengonopreparate due o più soluzioni stock (tab. 5) aconcentrazione elevata (100-200 volte più dellasoluzione nutritiva da somministrare alla coltura)utilizzando sali minerali per fertirrigazione (cioèparticolarmente puri e solubili) oppure concimicomplessi idrosolubili, in genere meno utilizzatiper la presenza di azoto ureico e/o ammoniacalein elevata quantità. La tab. 6 riporta le caratteristicheprincipali dei sali minerali più utilizzati per lafertirrigazione <strong>nel</strong>le serre e nei vivai (vedi ancheCapitolo 14).Il calcolo vero e proprio consiste <strong>nel</strong> determinarele quantità di sali e di acidi da aggiungereall’acqua irrigua per ottenere i valori di concentrazionenutritiva, di EC e di pH desiderati. Per farequesto sono necessari una serie di passaggi:1. scelta della ricetta nutritiva;2. calcolo della differenza <strong>nel</strong>la concentrazionedei vari elementi tra la ricetta e l’acqua irrigua;3. calcolo della quantità di acido (nitrico, fosforicoe/o solforico) necessaria all’aggiustamentodel pH e <strong>delle</strong> quantità di N, P, o S apportatecon l’acidificazione;4. calcolo, per ciascun elemento, della quantità diconcime da apportare rispettando l’ordineseguente: calcio, ammonio, fosforo, magnesio,nitrato, potassio, solfato, ferro, microelementi.Per raggiungere le concentrazioni desiderate<strong>nel</strong>la soluzione nutritiva sarà necessario che almenouno ione sia libero di variare in un certo range.Questo ione è generalmente il solfato, perché lepiante sono meno influenzate dalla concentrazionedi quest’elemento.Un esempio di calcoloL’esempio illustrato di seguito è riassunto <strong>nel</strong>latab. 7. Il calcolo della quantità di acido necessariaper l’aggiustamento del pH tiene conto della concentrazioneequivalente di carbonati e/o bicarbonatie del pH desiderato, e si effettua secondo laseguente equazione:[HA]=[HCO 3-] / (1+10 pH - pKa ) Eq. 3dove pKa (costante di dissociazione dell’acido carbonico)= 6,35.Dall’equazione risulta che una concentrazionedi acido [HA] pari al 70% della concentrazione dibicarbonati determina un pH della soluzione di6.0 (vedi Capitolo 10 per una trattazione più approfonditadell’argomento). Il calcolo, comunque,deve prevedere di lasciare in soluzione almeno 0,5-
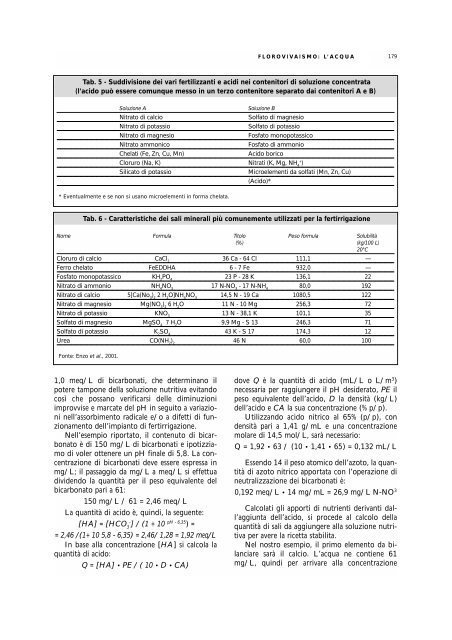
FLOROVIVAISMO: L’ACQUA179Tab. 5 - Suddivisione dei vari fertilizzanti e acidi nei contenitori di soluzione concentrata(l’acido può essere comunque messo in un terzo contenitore separato dai contenitori A e B)Soluzione ASoluzione BNitrato di calcioSolfato di magnesioNitrato di potassioSolfato di potassioNitrato di magnesioFosfato monopotassicoNitrato ammonicoFosfato di ammonioChelati (Fe, Zn, Cu, Mn)Acido boricoCloruro (Na, K) Nitrati (K, Mg, NH 4+)Silicato di potassioMicroelementi da solfati (Mn, Zn, Cu)(Acido)** Eventualmente e se non si usano microelementi in forma chelata.Tab. 6 - Caratteristiche dei sali minerali più comunemente utilizzati per la fertirrigazioneNome Formula Titolo Peso formula Solubilità(%) (kg/100 L)20°CCloruro di calcio CaCl 236 Ca - 64 Cl 111,1 —Ferro chelato FeEDDHA 6 - 7 Fe 932,0 —Fosfato monopotassico KH 2PO 423 P - 28 K 136,1 22Nitrato di ammonio NH 4NO 317 N-NO 3- 17 N-NH 480,0 192Nitrato di calcio 5[Ca(No 3) 22 H 2O]NH 4NO 314,5 N - 19 Ca 1080,5 122Nitrato di magnesio Mg(NO 3) 26 H 2O 11 N - 10 Mg 256,3 72Nitrato di potassio KNO 313 N - 38,1 K 101,1 35Solfato di magnesio MgSO 47 H 2O 9,9 Mg - S 13 246,3 71Solfato di potassio K 2SO 443 K - S 17 174,3 12Urea CO(NH 2) 246 N 60,0 100Fonte: Enzo et al., 2001.1,0 meq/L di bicarbonati, che determinano ilpotere tampone della soluzione nutritiva evitandocosì che possano verificarsi <strong>delle</strong> diminuzioniimprovvise e marcate del pH in seguito a variazioni<strong>nel</strong>l’assorbimento radicale e/o a difetti di funzionamentodell’impianto di fertirrigazione.Nell’esempio riportato, il contenuto di bicarbonatoè di 150 mg/L di bicarbonati e ipotizziamodi voler ottenere un pH finale di 5,8. La concentrazionedi bicarbonati deve essere espressa inmg/L; il passaggio da mg/L a meq/L si effettuadividendo la quantità per il peso equivalente delbicarbonato pari a 61:150 mg/L / 61 = 2,46 meq/LLa quantità di acido è, quindi, la seguente:[HA] = [HCO 3-] / (1 + 10 pH - 6,35 ) == 2,46 /(1+ 10 5,8 - 6,35) = 2,46/ 1,28 = 1,92 meq/LIn base alla concentrazione [HA] si calcola laquantità di acido:Q = [HA] • PE / ( 10 • D • CA)dove Q è la quantità di acido (mL/L o L/m 3 )necessaria per raggiungere il pH desiderato, PE ilpeso equivalente dell’acido, D la densità (kg/L)dell’acido e CA la sua concentrazione (% p/p).Utilizzando acido nitrico al 65% (p/p), condensità pari a 1,41 g/mL e una concentrazionemolare di 14,5 mol/L, sarà necessario:Q = 1,92 • 63 / (10 • 1,41 • 65) = 0,132 mL/LEssendo 14 il peso atomico dell’azoto, la quantitàdi azoto nitrico apportata con l’operazione dineutralizzazione dei bicarbonati è:0,192 meq/L • 14 mg/mL = 26,9 mg/L N-NO 3Calcolati gli apporti di nutrienti derivanti dall’aggiuntadell’acido, si procede al calcolo dellaquantità di sali da aggiungere alla soluzione nutritivaper avere la ricetta stabilita.Nel nostro esempio, il primo elemento da bilanciaresarà il calcio. L’acqua ne contiene 61mg/L, quindi per arrivare alla concentrazione