- Page 1 and 2:
Este libro pertenece a: Nombre: Cur
- Page 3 and 4:
3 Síntesis de Tema 2 En el siguien
- Page 5 and 6:
Actividad exploratoria Revista cien
- Page 7 and 8:
Normas de seguridad en el laborator
- Page 9 and 10:
Sacar conclusiones y comunicar Bas
- Page 11 and 12:
Al finalizar esta unidad serás cap
- Page 13 and 14:
El agua se enfría y calienta Estud
- Page 15 and 16:
3 Nuevamente midan la temperatura c
- Page 17 and 18:
1. Sistemas termodinámicos Observa
- Page 19 and 20:
. Propiedades o funciones de estado
- Page 21 and 22:
La energía es una magnitud cuya un
- Page 23 and 24:
Experimentando con el trabajo y el
- Page 25 and 26:
Paso 6: Recopilación y ordenamient
- Page 27 and 28:
Observa las siguientes imágenes: C
- Page 29 and 30:
Paso 3. Remplazar los datos en la f
- Page 31 and 32:
ende, por la suma de todas las ener
- Page 33 and 34:
EJERCICIO RESUELTO Analicemos el si
- Page 35 and 36:
3. Primera ley de la termodinámica
- Page 37 and 38:
Puesto que ΔH equivale a una canti
- Page 39 and 40:
− 1,299 kJ/mol = [ ( 2 mol CO 2
- Page 41 and 42:
2. El cambio de entalpía para una
- Page 43 and 44:
4 Calcula la entalpía de reacción
- Page 45 and 46:
Paso 3. Sumaremos los procesos inte
- Page 47 and 48:
En las reacciones químicas, se rea
- Page 49 and 50:
El calor de combustión y el ahorro
- Page 51 and 52:
6 Considerando las siguientes ecuac
- Page 53 and 54:
Procesos espontáneos y no espontá
- Page 55 and 56: usando, además de sus conocimiento
- Page 57 and 58: Resulta que casi todas las reaccion
- Page 59 and 60: Temperatura y entropía CIeNCIA eN
- Page 61 and 62: . Entropía y desorden Volvamos a r
- Page 63 and 64: Cuando la temperatura y la presión
- Page 65 and 66: Procedimiento: Preparar cubos de hi
- Page 67 and 68: d. Entropías molares estándar •
- Page 69 and 70: Donde: ∑ corresponde a la sumator
- Page 71 and 72: Energía libre (G) Diagrama A Diagr
- Page 73 and 74: En síntesis, el valor de ΔG está
- Page 75 and 76: En el sitio http://www.educaplus.or
- Page 77 and 78: Paso 1. Identificación de la incó
- Page 79 and 80: Por ejemplo, durante la descomposic
- Page 81 and 82: Evalúa: Para finalizar, te invitam
- Page 83 and 84: Paso 5. Observa atentamente el valo
- Page 85 and 86: El calentamiento global La termodin
- Page 87 and 88: 2 El ácido fórmico (HCOOH) es emi
- Page 89 and 90: Camino a... 1. Cuando el sistema ab
- Page 91 and 92: Al finalizar esta unidad serás cap
- Page 93 and 94: ¡Qué veloz! ¡Qué lento! Estudia
- Page 95 and 96: 1. Velocidad de reacción Observa a
- Page 97 and 98: [ A 2 ] − [ A 1 ] Velocidad prome
- Page 99 and 100: [A] mol/L 0,12 0,1 0,08 0,06 0,04 0
- Page 101 and 102: . Naturaleza química y física de
- Page 103 and 104: c. Perfil de una reacción Los perf
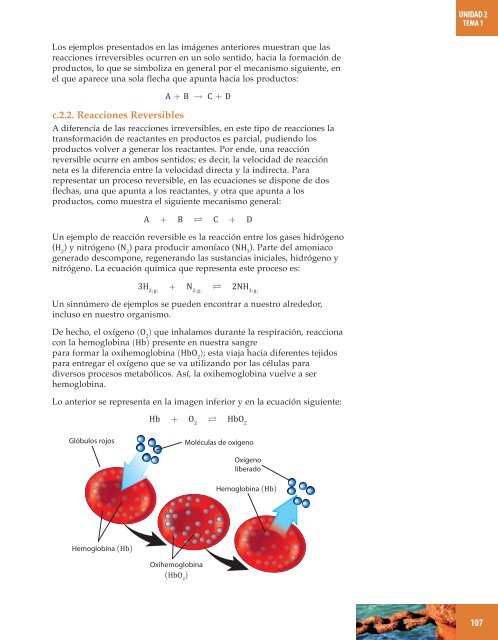
- Page 105: 1 Define y asocia los siguientes co
- Page 109 and 110: Donde: k, corresponde a la constant
- Page 111 and 112: c. ¿Recuerdas con qué finalidad s
- Page 113 and 114: Al igual que las reacciones de prim
- Page 115 and 116: 2. Factores que afectan la velocida
- Page 117 and 118: d. Temperatura El incremento de tem
- Page 119 and 120: EJERCICIO RESUELTO Analicemos el si
- Page 121 and 122: 3. Acción de los catalizadores e i
- Page 123 and 124: . Catálisis enzimática La catáli
- Page 125 and 126: Hoja de metal que actúa como catal
- Page 127 and 128: 4. Equilibrio químico Lee atentame
- Page 129 and 130: Concentración (mol/L) Reacción di
- Page 131 and 132: constante de equilibrio se consider
- Page 133 and 134: Al leer el principio: Subrayen las
- Page 135 and 136: 2 Dispongan ambas cápsulas sobre p
- Page 137 and 138: Paso 3. Observar atentamente el val
- Page 139 and 140: 5. Mecanismos de reacción Observa
- Page 141 and 142: a. Determinación de los mecanismos
- Page 143 and 144: Proceso de Haber- Bosch La industri
- Page 145 and 146: 7 La transformación del ozono en o
- Page 147 and 148: Camino a... 1. Según la cinética
- Page 149 and 150: Al finalizar esta unidad serás cap
- Page 151 and 152: Ácidos y bases Introducción Los
- Page 153 and 154: 1. Sustancias ácido - base Observa
- Page 155 and 156: 2. Teorías ácido - base Muchos qu
- Page 157 and 158:
. Teoría de Brönsted - Lowry Otra
- Page 159 and 160:
• ¿Cuál es el ácido, cuál es
- Page 161 and 162:
1 Completa la siguiente tabla resum
- Page 163 and 164:
Así la expresión de K , se consid
- Page 165 and 166:
Paso 5: Registro de observaciones R
- Page 167 and 168:
4. El pH Como hemos observado, las
- Page 169 and 170:
Para obtener el pH es necesario con
- Page 171 and 172:
Es decir: si pH = − log [ H + ] ,
- Page 173 and 174:
1 Completa los datos de la siguient
- Page 175 and 176:
El ojo humano es poco sensible, por
- Page 177 and 178:
Análogamente, cuanto más fácilme
- Page 179 and 180:
. Porcentaje de ionización Además
- Page 181 and 182:
d. Cálculo de pH en ácidos y base
- Page 183 and 184:
K a es un valor conocido (1,8 · 10
- Page 185 and 186:
Lean, observen y analicen el siguie
- Page 187 and 188:
1 Determinen el pH de las siguiente
- Page 189 and 190:
Neutralización Estudiaremos Proces
- Page 191 and 192:
8. Neutralización Observa la imág
- Page 193 and 194:
Ahora bien, si no disponemos de uno
- Page 195 and 196:
Volumetría ácido-base Estudiaremo
- Page 197 and 198:
9. Titulaciones ácido - base Al pr
- Page 199 and 200:
Momento de la titulación Relación
- Page 201 and 202:
OH - OH - V HCl = 0 mL OH - OH - OH
- Page 203 and 204:
¿Por qué se produce esto? Al agre
- Page 205 and 206:
Paso 7: Análisis de datos 1 ¿Qué
- Page 207 and 208:
2. En disolución, la sal del ácid
- Page 209 and 210:
Sistemas amortiguadores de importan
- Page 211 and 212:
2 ¿Cuál es el pH de un buffer pre
- Page 213 and 214:
Reacciones redox Estudiaremos Proce
- Page 215 and 216:
1. Oxidación y reducción Observa
- Page 217 and 218:
Paso 2. Seleccionar las fórmulas.
- Page 219 and 220:
Sin embargo, existen algunas excepc
- Page 221 and 222:
después a 30 metros bajo el agua,
- Page 223 and 224:
Se tiene entonces: Zn → Zn 2+ + 2
- Page 225 and 226:
4. Balance de ecuaciones Redox Obse
- Page 227 and 228:
EJERCICIO RESUELTO Estableceremos e
- Page 229 and 230:
Las reacciones Redox son muy import
- Page 231 and 232:
Ensayo 2 Usando 2 cables, unan el L
- Page 233 and 234:
Zn ánodo Zn ( s ) Interruptor e -
- Page 235 and 236:
Celdas electrolíticas Estudiaremos
- Page 237 and 238:
. Electrólisis y celdas electrolí
- Page 239 and 240:
Lee atentamente el siguiente texto
- Page 241 and 242:
Como mencionamos anteriormente, exi
- Page 243 and 244:
Entendiendo en todos los casos que
- Page 245 and 246:
4 Determina el potencial estándar
- Page 247 and 248:
Paso 4. Resolver. Como las condicio
- Page 249 and 250:
Paso 6: Recopilación y ordenamient
- Page 251 and 252:
La cantidad de agua asociada con el
- Page 253 and 254:
Observa atentamente las imágenes q
- Page 255 and 256:
El concentrado de cobre seco, con u
- Page 257 and 258:
9 ¿Cuándo se puede saber si una e
- Page 259 and 260:
Camino a... 1. Para que un proceso
- Page 261 and 262:
Al finalizar esta unidad serás cap
- Page 263 and 264:
Polímeros en construcción Introdu
- Page 265 and 266:
1. Polímeros Observa atentamente l
- Page 267 and 268:
Los copolímeros pueden formar cuat
- Page 269 and 270:
Paso 7: Análisis de datos En el an
- Page 271 and 272:
Muchas de las propiedades de los po
- Page 273 and 274:
a.2. Propiedades físicas Según la
- Page 275 and 276:
1 Completa el siguiente organizador
- Page 277 and 278:
. Formación de polímeros La sigui
- Page 279 and 280:
- Iniciación: Al adicionar el áci
- Page 281 and 282:
Propagación. El radical formado re
- Page 283 and 284:
Antes de continuar, reflexiona sobr
- Page 285 and 286:
3.Aplicaciones de los polímeros si
- Page 287 and 288:
. Impacto en el ambiente Es posible
- Page 289 and 290:
Método Procedimiento Ejemplo de pr
- Page 291 and 292:
Plásticos biodegradables Hemos abo
- Page 293 and 294:
2 Establece la reacción de los sig
- Page 295 and 296:
Polímeros Naturales Introducción
- Page 297 and 298:
1. Polímeros naturales • ¿Recue
- Page 299 and 300:
5 A los tubos enumerados del 4 al 6
- Page 301 and 302:
2. Aminoácidos Observa atentamente
- Page 303 and 304:
Observando la estructura del Zwitte
- Page 305 and 306:
NH2 Arginina Arg HN C NH CH2 CH2 CH
- Page 307 and 308:
H H H H N N H H o H C C + N R C C R
- Page 309 and 310:
3 Observa atentamente el siguiente
- Page 311 and 312:
4 Enumera los cuatros tubos de ensa
- Page 313 and 314:
Gly Pro Hydroxy-Pro Gly Pro Hydroxy
- Page 315 and 316:
Estructura primeria (aminoácidos e
- Page 317 and 318:
Las proteínas ribosómicas, alguna
- Page 319 and 320:
1 Completa las siguientes oraciones
- Page 321 and 322:
c. Propiedades y funciones biológi
- Page 323 and 324:
1 Responde las aseveraciones, antep
- Page 325 and 326:
6 El ADN comenzará a “coagular
- Page 327 and 328:
- Base nitrogenada: Es una estructu
- Page 329 and 330:
a. Origen y estructura de los ácid
- Page 331 and 332:
. El mensaje genético La función
- Page 333 and 334:
1 Responde las siguientes preguntas
- Page 335 and 336:
4 Lee el siguiente texto, y luego r
- Page 337 and 338:
Paso 4: Diseño experimental Elabor
- Page 339 and 340:
Cuando se une una gran cantidad de
- Page 341 and 342:
Los péptidos son el ingrediente es
- Page 343 and 344:
3 Observa atentamente la siguiente
- Page 345 and 346:
Camino a... 1. Un aminoácido prese
- Page 347 and 348:
Al finalizar esta unidad serás cap
- Page 349 and 350:
Simulación de la determinación de
- Page 351 and 352:
1. Propiedades y estabilidad del n
- Page 353 and 354:
La mayoría de los elementos están
- Page 355 and 356:
Si comparamos la masa de los nucleo
- Page 357 and 358:
neutrones o entre un protón y un n
- Page 359 and 360:
c.3. Análisis energético de la es
- Page 361 and 362:
1 Observa el gráfico y responde la
- Page 363 and 364:
2. Radiactividad Observa la siguien
- Page 365 and 366:
Procedimiento: • Debes tener cuid
- Page 367 and 368:
Observa la siguiente imagen: Partí
- Page 369 and 370:
Opciones Significado + He logrado e
- Page 371 and 372:
Cuando este proceso de fisión nucl
- Page 373 and 374:
Observa atentamente la siguiente im
- Page 375 and 376:
238 U a 92 234 Th b 90 234 Pa b 91
- Page 377 and 378:
3 Considerando que el gráfico mues
- Page 379 and 380:
4 Sobre una hoja blanca, con la ayu
- Page 381 and 382:
3. Velocidad de desintegración Ima
- Page 383 and 384:
a. Vida media Observa el gráfico q
- Page 385 and 386:
Tabla 27 Rapidez de desintegración
- Page 387 and 388:
Simulación de la desintegración r
- Page 389 and 390:
.1. Datación con Carbono (C-14) La
- Page 391 and 392:
La radiactividad en el tabaco Adapt
- Page 393 and 394:
II. Desarrolla los siguientes ejerc
- Page 395 and 396:
Usos de la energía nuclear en Chil
- Page 397 and 398:
1. Reactores y centrales nucleares
- Page 399 and 400:
El primer reactor construido en el
- Page 401 and 402:
• La cuarta barrera la constituye
- Page 403 and 404:
c. Ventajas y desventajas La produc
- Page 405 and 406:
Proyecto HidroÁysen Proyecto que c
- Page 407 and 408:
2. Aplicaciones de radioisótopos
- Page 409 and 410:
Al respecto, la CCHEN (Comisión Ch
- Page 411 and 412:
d. Industria Las aplicaciones de lo
- Page 413 and 414:
3. Armas nucleares Lee atentamente
- Page 415 and 416:
Una bomba nuclear consiste básicam
- Page 417 and 418:
d. Manejo de los residuos nucleares
- Page 419 and 420:
4. Efecto en los seres vivos Lee at
- Page 421 and 422:
a. Efecto en los tejidos vivos Como
- Page 423 and 424:
Tabla 32 Radiación a la que está
- Page 425 and 426:
¡Alimentos irradiados! Hoy en día
- Page 427 and 428:
III. Une los conceptos enumerados e
- Page 429 and 430:
Camino a... 1. ¿Qué tipo de radia
- Page 431 and 432:
TEMA 2 Página 58 Desafío 1 Clavos
- Page 433 and 434:
Página 131 Desafío [ H 2 x ] [ I
- Page 435 and 436:
c. [ H + ] = [ O H − ] = 9,79 ⋅
- Page 437 and 438:
3 Alcohol y éter. Página 267 Desa
- Page 439 and 440:
Páginas 376 - 377 Desafío 1 a. De
- Page 441 and 442:
Ácidos 151, 153, 154 Ácidos nucle
- Page 443 and 444:
Polímero lineal 263 Polímero rami
- Page 445 and 446:
UNIDAD 2: Cinética y equilibrio qu
- Page 447 and 448:
Monosacárido: Son los glúcidos m