- Seite 1:
Aus dem Institut für Molekulare Me
- Seite 5 und 6:
Inhaltsverzeichnis 1 Zusammenfassun
- Seite 7 und 8:
4.3.3 Gelelektrophorese zur Analyse
- Seite 9 und 10:
5.12 Untersuchung des Einusses von
- Seite 11 und 12:
1 Zusammenfassung Die RNA-Interfere
- Seite 13 und 14:
Summary RNA interference (RNAi) is
- Seite 15 und 16:
2 Einleitung 2.1 Über die Bedeutun
- Seite 17 und 18:
2.2 Genregulation durch RNA-Interfe
- Seite 19 und 20:
2.2 Genregulation durch RNA-Interfe
- Seite 21 und 22:
2.3 Die Familie der Argonaute Prote
- Seite 23 und 24:
2.3 Die Familie der Argonaute Prote
- Seite 25 und 26:
2.3 Die Familie der Argonaute Prote
- Seite 27 und 28:
2.3 Die Familie der Argonaute Prote
- Seite 29 und 30:
2.3 Die Familie der Argonaute Prote
- Seite 31 und 32:
2.4 Die strukturellen und molekular
- Seite 33 und 34:
2.4 Die strukturellen und molekular
- Seite 35 und 36:
2.5 Die Kinetik der siRNA-vermittel
- Seite 37 und 38:
2.5 Die Kinetik der siRNA-vermittel
- Seite 39 und 40:
2.6 Die Familie der dsRNA-bindenden
- Seite 41 und 42:
2.6 Die Familie der dsRNA-bindenden
- Seite 43:
2.7 Ziel dieser Arbeit der Freisetz
- Seite 46 und 47:
3 Material Deutschland), Roche (Bas
- Seite 48 und 49:
3 Material UV-Quarzküvetten (70 µ
- Seite 50 und 51:
3 Material Stains-All Sigma-Aldrich
- Seite 52 und 53: 3 Material Coomassie-Entfärbelösu
- Seite 54 und 55: 3 Material Trenngelpuer (4×) 1,5 M
- Seite 56 und 57: 3 Material pQE-T7-His-hAgo2 Eigensc
- Seite 58 und 59: 3 Material 3.8.4 Primer Name Ago2 f
- Seite 60 und 61: 3 Material Anti-Tetra-His (monoklon
- Seite 62 und 63: 4 Methoden Mini-Präparation (klein
- Seite 64 und 65: 4 Methoden Acrylamidkonzentration (
- Seite 66 und 67: 4 Methoden 4.1.6 Restriktionshydrol
- Seite 68 und 69: 4 Methoden 4.1.11 Kryokonservierung
- Seite 70 und 71: 4 Methoden Die in vitro Transkripti
- Seite 72 und 73: 4 Methoden 5'-Endmarkierung wurde u
- Seite 74 und 75: 4 Methoden schwache Absorption aufw
- Seite 76 und 77: 4 Methoden Komponente Sammelgel Tre
- Seite 78 und 79: 4 Methoden Es wurde für 90 min ein
- Seite 80 und 81: 4 Methoden Protein Temperatur der H
- Seite 82 und 83: 4 Methoden Die Rückfaltung von hAg
- Seite 84 und 85: 4 Methoden Reinigung von hTRBP-His
- Seite 86 und 87: 4 Methoden Ansätzen zum Reaktionss
- Seite 88 und 89: 4 Methoden Abbildung 4.1: Schematis
- Seite 90 und 91: 4 Methoden Xenon‐Lampe Excitation
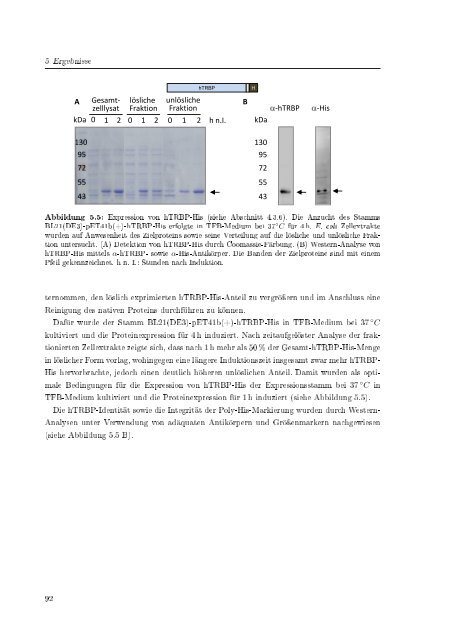
- Seite 92 und 93: 4 Methoden gewertet; allerdings die
- Seite 94 und 95: 4 Methoden verwendeten Lösungsmitt
- Seite 96 und 97: 5 Ergebnisse NHA-hAgo2 nur in Anwes
- Seite 98 und 99: 5 Ergebnisse NHA hAgo2 A kDa Gesamt
- Seite 100 und 101: 5 Ergebnisse Konstrukte wurden mit
- Seite 104 und 105: 5 Ergebnisse NHA hAgo2 A DNaseI & T
- Seite 106 und 107: 5 Ergebnisse konnte mit der bisher
- Seite 108 und 109: 5 Ergebnisse Präzipitationskontrol
- Seite 110 und 111: 5 Ergebnisse Studien zur Optimierun
- Seite 112 und 113: 5 Ergebnisse zum Anderen den angest
- Seite 114 und 115: 5 Ergebnisse 5.4.3 Entwicklung eine
- Seite 116 und 117: 5 Ergebnisse die Experimente in ein
- Seite 118 und 119: 5 Ergebnisse 5.5.3 Einuss der Tempe
- Seite 120 und 121: 5 Ergebnisse In beiden Experimenten
- Seite 122 und 123: Mass (%) 5 Ergebnisse NHA hAgo2 90
- Seite 124 und 125: 5 Ergebnisse NHA hAgo2 A 110 100 B
- Seite 126 und 127: 5 Ergebnisse säuren und durch SYBR
- Seite 128 und 129: 5 Ergebnisse Bereich bestimmen [204
- Seite 130 und 131: 5 Ergebnisse der Gelverzögerungs-A
- Seite 132 und 133: 5 Ergebnisse Oligomerisierungszusta
- Seite 134 und 135: Fluoreszenz cpm 5 Ergebnisse GST hA
- Seite 136 und 137: Fluoreszenz 5 Ergebnisse Bestimmung
- Seite 138 und 139: 5 Ergebnisse mit unterschiedlichen
- Seite 140 und 141: elative Fluoreszenz relative Fluore
- Seite 142 und 143: elative Fluoreszenz k 1, obs (s -1
- Seite 144 und 145: 5 Ergebnisse Entlassung des guide R
- Seite 146 und 147: 5 Ergebnisse A B C FAM FAM P P‐as
- Seite 148 und 149: Fluoreszenz 5 Ergebnisse GST hAgo2
- Seite 150 und 151: 5 Ergebnisse guide RNA target RNA k
- Seite 152 und 153:
Fluoreszenz 5 Ergebnisse GST hAgo2
- Seite 154 und 155:
5 Ergebnisse und ist somit konsiste
- Seite 156 und 157:
5 Ergebnisse k = 0,0004 (± 0,00001
- Seite 158 und 159:
% Umsatz % Umsatz 1/ k k (s -1 ) 5
- Seite 160 und 161:
% Umsatz 5 Ergebnisse Einsatz der k
- Seite 162 und 163:
5 Ergebnisse FAM P BHQ 2h 25°C FAM
- Seite 164 und 165:
Fluoreszenz 5 Ergebnisse Wie unter
- Seite 166 und 167:
Fluoreszenz Fluoreszenz 5 Ergebniss
- Seite 168 und 169:
elative Fluoreszenz k 1, obs (s -1
- Seite 170 und 171:
5 Ergebnisse 5.11.3 Zusammenfassung
- Seite 172 und 173:
% Umsatz 5 Ergebnisse wird, stehen
- Seite 175 und 176:
6 Diskussion Das Protein hAgo2 stel
- Seite 177 und 178:
6.1 Untersuchung der siRNA-vermitte
- Seite 179 und 180:
6.2 Stabilität von rekombinantem h
- Seite 181 und 182:
6.3 Charakterisierung der siRNA-ver
- Seite 183 und 184:
6.3 Charakterisierung der siRNA-ver
- Seite 185 und 186:
6.3 Charakterisierung der siRNA-ver
- Seite 187 und 188:
6.3 Charakterisierung der siRNA-ver
- Seite 189 und 190:
6.3 Charakterisierung der siRNA-ver
- Seite 191 und 192:
6.3 Charakterisierung der siRNA-ver
- Seite 193 und 194:
6.3 Charakterisierung der siRNA-ver
- Seite 195 und 196:
6.3 Charakterisierung der siRNA-ver
- Seite 197 und 198:
6.3 Charakterisierung der siRNA-ver
- Seite 199 und 200:
6.4 Charakterisierung der siRNA-Bin
- Seite 201 und 202:
6.4 Charakterisierung der siRNA-Bin
- Seite 203 und 204:
6.5 Modell der minimalen rekombinan
- Seite 205 und 206:
6.6 Ausblick einer konformationelle
- Seite 207 und 208:
7 Literaturverzeichnis [1] Paterson
- Seite 209 und 210:
7 Literaturverzeichnis [23] Stefani
- Seite 211 und 212:
7 Literaturverzeichnis [47] Czech,
- Seite 213 und 214:
7 Literaturverzeichnis [70] Gregory
- Seite 215 und 216:
7 Literaturverzeichnis [93] Lee, D.
- Seite 217 und 218:
7 Literaturverzeichnis [115] Aravin
- Seite 219 und 220:
7 Literaturverzeichnis [136] Ohrt,
- Seite 221 und 222:
7 Literaturverzeichnis [160] Montgo
- Seite 223 und 224:
7 Literaturverzeichnis [184] Schube
- Seite 225 und 226:
7 Literaturverzeichnis [208] Tian,
- Seite 227 und 228:
7 Literaturverzeichnis [227] Lee, K
- Seite 229 und 230:
7 Literaturverzeichnis [250] Ehresm
- Seite 231:
7 Literaturverzeichnis [272] van Ho
- Seite 234 und 235:
A Anhang Bindungspartner miteinande
- Seite 236 und 237:
A Anhang mit B = Basislinie der Aut
- Seite 238 und 239:
A Anhang Erk extrazellulär regulie
- Seite 240 und 241:
A Anhang NMR nuclear magnetic reson
- Seite 242 und 243:
A Anhang Å Ångström µF Mikrofar
- Seite 244 und 245:
A Anhang 5.34 Pre-steady state Asso
- Seite 246 und 247:
A Anhang 5.5 Übersicht über die b
- Seite 248 und 249:
A Anhang meinen Freunden für Vers
- Seite 250 und 251:
Andrea Deerberg Stipendien 09/2011
- Seite 252 und 253:
Publikationsliste Originalartikel 2