Biochemische Charakterisierung der siRNA-vermittelten Erkennung ...
Biochemische Charakterisierung der siRNA-vermittelten Erkennung ...
Biochemische Charakterisierung der siRNA-vermittelten Erkennung ...
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
elative Fluoreszenz<br />
k 1, obs (s -1 )<br />
relative Fluoreszenz<br />
k 1, obs (s -1 )<br />
5.7 <strong>Charakterisierung</strong> <strong>der</strong> <strong>siRNA</strong>-Bindung durch hAgo2<br />
Untersuchung <strong>der</strong> Assoziation und Dissoziation von ssRNA und hAgo2<br />
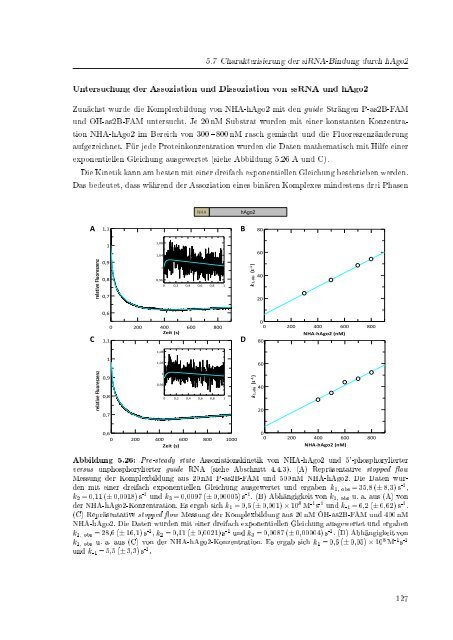
Zunächst wurde die Komplexbildung von NHA-hAgo2 mit den guide Strängen P-as2B-FAM<br />
und OH-as2B-FAM untersucht. Je 20 nM Substrat wurden mit einer konstanten Konzentration<br />
NHA-hAgo2 im Bereich von 300 800 nM rasch gemischt und die Fluoreszenzän<strong>der</strong>ung<br />
aufgezeichnet. Für jede Proteinkonzentration wurden die Daten mathematisch mit Hilfe einer<br />
exponentiellen Gleichung ausgewertet (siehe Abbildung 5.26 A und C).<br />
Die Kinetik kann am besten mit einer dreifach exponentiellen Gleichung beschrieben werden.<br />
Das bedeutet, dass während <strong>der</strong> Assoziation eines binären Komplexes mindestens drei Phasen<br />
NHA<br />
hAgo2<br />
A<br />
1,1<br />
B<br />
80<br />
1<br />
0,9<br />
0,8<br />
1,08<br />
1,04<br />
1<br />
0,96<br />
0 0,2 0,4 0,6 0,8 1<br />
60<br />
40<br />
0,7<br />
20<br />
0,6<br />
C<br />
1,1<br />
0 200 400 600 800<br />
Zeit (s)<br />
D<br />
0<br />
0 200 400 600 800<br />
NHA-hAgo2 (nM)<br />
80<br />
1<br />
1,08<br />
1,04<br />
60<br />
0,9<br />
1<br />
0,96<br />
40<br />
0,8<br />
0 0,2 0,4 0,6 0,8 1<br />
0,7<br />
20<br />
0,6<br />
0 200 400 600 800 1000<br />
Zeit (s)<br />
0<br />
0 200 400 600 800<br />
NHA-hAgo2 (nM)<br />
Abbildung 5.26: Pre-steady state Assoziationskinetik von NHA-hAgo2 und 5'-phosphorylierter<br />
versus unphosphorylierter guide RNA (siehe Abschnitt 4.4.3). (A) Repräsentative stopped ow<br />
Messung <strong>der</strong> Komplexbildung aus 20 nM P-as2B-FAM und 500 nM NHA-hAgo2. Die Daten wurden<br />
mit einer dreifach exponentiellen Gleichung ausgewertet und ergaben k 1, obs = 35,8 (± 8,3) s -1 ,<br />
k 2 = 0,11 (± 0,0018) s -1 und k 3 = 0,0097 (± 0,00005) s -1 . (B) Abhängigkeit von k 1, obs u. a. aus (A) von<br />
<strong>der</strong> NHA-hAgo2-Konzentration. Es ergab sich k 1 = 0,6 (± 0,001) × 10 8 M -1 s -1 und k -1 = 6,2 (± 0,62) s -1 .<br />
(C) Repräsentative stopped ow Messung <strong>der</strong> Komplexbildung aus 20 nM OH-as2B-FAM und 400 nM<br />
NHA-hAgo2. Die Daten wurden mit einer dreifach exponentiellen Gleichung ausgewertet und ergaben<br />
k 1, obs = 28,6 (± 16,1) s -1 , k 2 = 0,11 (± 0,0021) s -1 und k 3 = 0,0087 (± 0,00004) s -1 . (D) Abhängigkeit von<br />
k 1, obs u. a. aus (C) von <strong>der</strong> NHA-hAgo2-Konzentration. Es ergab sich k 1 = 0,6 (± 0,05) × 10 8 M -1 s -1<br />
und k -1 = 5,5 (± 3,3) s -1 .<br />
127