Biochemische Charakterisierung der siRNA-vermittelten Erkennung ...
Biochemische Charakterisierung der siRNA-vermittelten Erkennung ...
Biochemische Charakterisierung der siRNA-vermittelten Erkennung ...
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
elative Fluoreszenz<br />
k 1, obs (s -1 )<br />
5.8 <strong>Charakterisierung</strong> <strong>der</strong> target RNA-Bindung durch den binären hAgo2/guide RNA-Komplex<br />
GST<br />
hAgo2<br />
A<br />
7<br />
6<br />
5<br />
4<br />
6<br />
5,8<br />
5,6<br />
5,4<br />
5,2<br />
5<br />
4,8<br />
B<br />
50<br />
40<br />
30<br />
3<br />
4,6<br />
0 0,2 0,4 0,6 0,8<br />
20<br />
2<br />
1<br />
10<br />
0<br />
0 200 400 600 800 1000<br />
Zeit (s)<br />
0<br />
0 20 40 60 80<br />
s2B-BHQ (nM)<br />
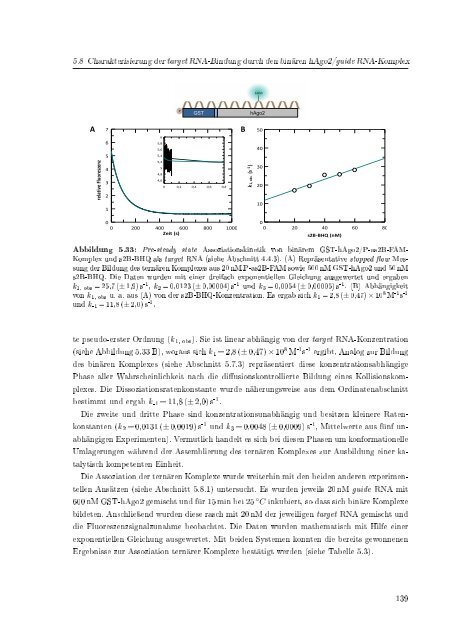
Abbildung 5.33: Pre-steady state Assoziationskinetik von binärem GST-hAgo2/P-as2B-FAM-<br />
Komplex und s2B-BHQ als target RNA (siehe Abschnitt 4.4.3). (A) Repräsentative stopped ow Messung<br />
<strong>der</strong> Bildung des ternären Komplexes aus 20 nM P-as2B-FAM sowie 600 nM GST-hAgo2 und 50 nM<br />
s2B-BHQ. Die Daten wurden mit einer dreifach exponentiellen Gleichung ausgewertet und ergaben<br />
k 1, obs = 25,7 (± 1,9) s -1 , k 2 = 0,0123 (± 0,00004) s -1 und k 3 = 0,0054 (± 0,00005) s -1 . (B) Abhängigkeit<br />
von k 1, obs u. a. aus (A) von <strong>der</strong> s2B-BHQ-Konzentration. Es ergab sich k 1 = 2,8 (± 0,47) × 10 8 M -1 s -1<br />
und k -1 = 11,8 (± 2,0) s -1 .<br />
te pseudo-erster Ordnung (k 1, obs ). Sie ist linear abhängig von <strong>der</strong> target RNA-Konzentration<br />
(siehe Abbildung 5.33 B), woraus sich k 1 = 2,8 (± 0,47) × 10 8 M -1 s -1 ergibt. Analog zur Bildung<br />
des binären Komplexes (siehe Abschnitt 5.7.3) repräsentiert diese konzentrationsabhängige<br />
Phase aller Wahrscheinlichkeit nach die diusionskontrollierte Bildung eines Kollisionskomplexes.<br />
Die Dissoziationsratenkonstante wurde näherungsweise aus dem Ordinatenabschnitt<br />
bestimmt und ergab k -1 = 11,8 (± 2,0) s -1 .<br />
Die zweite und dritte Phase sind konzentrationsunabhängig und besitzen kleinere Ratenkonstanten<br />
(k 2 = 0,0131 (± 0,0019) s -1 und k 3 = 0,0048 (± 0,0009) s -1 , Mittelwerte aus fünf unabhängigen<br />
Experimenten). Vermutlich handelt es sich bei diesen Phasen um konformationelle<br />
Umlagerungen während <strong>der</strong> Assemblierung des ternären Komplexes zur Ausbildung einer katalytisch<br />
kompetenten Einheit.<br />
Die Assoziation <strong>der</strong> ternären Komplexe wurde weiterhin mit den beiden an<strong>der</strong>en experimentellen<br />
Ansätzen (siehe Abschnitt 5.8.1) untersucht. Es wurden jeweils 20 nM guide RNA mit<br />
600 nM GST-hAgo2 gemischt und für 15 min bei 25 ◦ C inkubiert, so dass sich binäre Komplexe<br />
bildeten. Anschlieÿend wurden diese rasch mit 20 nM <strong>der</strong> jeweiligen target RNA gemischt und<br />
die Fluoreszenzsignalzunahme beobachtet. Die Daten wurden mathematisch mit Hilfe einer<br />
exponentiellen Gleichung ausgewertet. Mit beiden Systemen konnten die bereits gewonnenen<br />
Ergebnisse zur Assoziation ternärer Komplexe bestätigt werden (siehe Tabelle 5.3).<br />
139