Biochemische Charakterisierung der siRNA-vermittelten Erkennung ...
Biochemische Charakterisierung der siRNA-vermittelten Erkennung ...
Biochemische Charakterisierung der siRNA-vermittelten Erkennung ...
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
Fluoreszenz<br />
relative Fluoreszenz<br />
5.11 <strong>Charakterisierung</strong> <strong>der</strong> <strong>siRNA</strong>-Bindung durch hTRBP<br />
hTRBP<br />
H<br />
A<br />
8500<br />
B<br />
1,4<br />
8000<br />
1,3<br />
7500<br />
1,2<br />
7000<br />
1,1<br />
6500<br />
0 100 200 300 400<br />
hTRBP-His (nM)<br />
1<br />
0 100 200 300 400 500 600<br />
siLam (nM)<br />
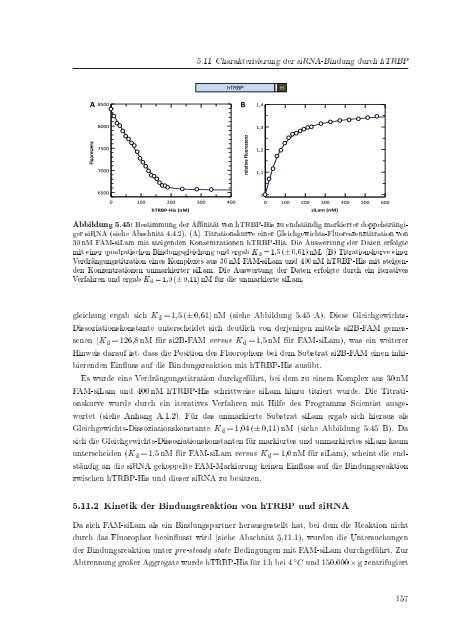
Abbildung 5.45: Bestimmung <strong>der</strong> Afnität von hTRBP-His zu endständig markierter doppelsträngiger<br />
<strong>siRNA</strong> (siehe Abschnitt 4.4.2). (A) Titrationskurve einer Gleichgewichts-Fluoreszenztitration von<br />
30 nM FAM-siLam mit steigenden Konzentrationen hTRBP-His. Die Auswertung <strong>der</strong> Daten erfolgte<br />
mit einer quadratischen Bindungsgleichung und ergab K d = 1,5 (± 0,61) nM. (B) Titrationskurve einer<br />
Verdrängungstitration eines Komplexes aus 30 nM FAM-siLam und 400 nM hTRBP-His mit steigenden<br />
Konzentrationen unmarkierter siLam. Die Auswertung <strong>der</strong> Daten erfolgte durch ein iteratives<br />
Verfahren und ergab K d = 1,0 (± 0,11) nM für die unmarkierte siLam.<br />
gleichung ergab sich K d = 1,5 (± 0,61) nM (siehe Abbildung 5.45 A). Diese Gleichgewichts-<br />
Dissoziationskonstante unterscheidet sich deutlich von <strong>der</strong>jenigen mittels si2B-FAM gemessenen<br />
(K d = 126,8 nM für si2B-FAM versus K d = 1,5 nM für FAM-siLam), was ein weiterer<br />
Hinweis darauf ist, dass die Position des Fluorophors bei dem Substrat si2B-FAM einen inhibierenden<br />
Einuss auf die Bindungsreaktion mit hTRBP-His ausübt.<br />
Es wurde eine Verdrängungstitration durchgeführt, bei dem zu einem Komplex aus 30 nM<br />
FAM-siLam und 400 nM hTRBP-His schrittweise siLam hinzu titriert wurde. Die Titrationskurve<br />
wurde durch ein iteratives Verfahren mit Hilfe des Programms Scientist ausgewertet<br />
(siehe Anhang A.1.2). Für das unmarkierte Substrat siLam ergab sich hieraus als<br />
Gleichgewichts-Dissoziationskonstante K d = 1,04 (± 0,11) nM (siehe Abbildung 5.45 B). Da<br />
sich die Gleichgewichts-Dissoziationskonstanten für markiertes und unmarkiertes siLam kaum<br />
unterscheiden (K d = 1,5 nM für FAM-siLam versus K d = 1,0 nM für siLam), scheint die endständig<br />
an die <strong>siRNA</strong> gekoppelte FAM-Markierung keinen Einuss auf die Bindungsreaktion<br />
zwischen hTRBP-His und dieser <strong>siRNA</strong> zu besitzen.<br />
5.11.2 Kinetik <strong>der</strong> Bindungsreaktion von hTRBP und <strong>siRNA</strong><br />
Da sich FAM-siLam als ein Bindungspartner herausgestellt hat, bei dem die Reaktion nicht<br />
durch das Fluorophor beeinusst wird (siehe Abschnitt 5.11.1), wurden die Untersuchungen<br />
<strong>der</strong> Bindungsreaktion unter pre-steady state Bedingungen mit FAM-siLam durchgeführt. Zur<br />
Abtrennung groÿer Aggregate wurde hTRBP-His für 1 h bei 4 ◦ C und 150.000 × g zentrifugiert<br />
157