Biochemische Charakterisierung der siRNA-vermittelten Erkennung ...
Biochemische Charakterisierung der siRNA-vermittelten Erkennung ...
Biochemische Charakterisierung der siRNA-vermittelten Erkennung ...
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
5.6 <strong>Biochemische</strong> <strong>Charakterisierung</strong> von rekombinantem hTRBP<br />
hTRBP<br />
H<br />
A<br />
Population<br />
t R, berechnet<br />
(min)<br />
Molekulargewicht<br />
(kDa)<br />
Monomer 29,4 40,4<br />
Dimer 26,8 80,8<br />
Tetramer 25,2 161,5<br />
A 280<br />
B<br />
0,20<br />
0,15<br />
0,10<br />
0,05<br />
0,00<br />
-0,05<br />
kDa<br />
55<br />
Tetramer<br />
Dimer<br />
Monomer<br />
Puffer<br />
A B C D<br />
43<br />
Auftrag A B C D<br />
C<br />
t R (min)<br />
A 280<br />
0,25<br />
0,20<br />
0,15<br />
0,10<br />
0,05<br />
0,00<br />
-0,05<br />
Tetramer<br />
Dimer<br />
Monomer<br />
Puffer<br />
*<br />
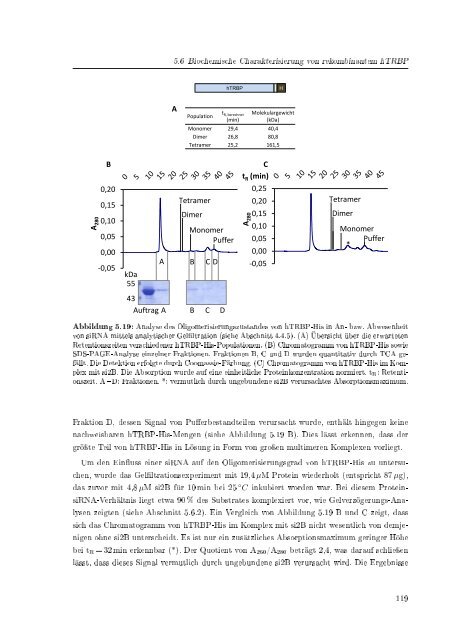
Abbildung 5.19: Analyse des Oligomerisierungszustandes von hTRBP-His in An- bzw. Abwesenheit<br />
von <strong>siRNA</strong> mittels analytischer Gelltration (siehe Abschnitt 4.4.5). (A) Übersicht über die erwarteten<br />
Retentionszeiten verschiedener hTRBP-His-Populationen. (B) Chromatogramm von hTRBP-His sowie<br />
SDS-PAGE-Analyse einzelner Fraktionen. Fraktionen B, C und D wurden quantitativ durch TCA gefällt.<br />
Die Detektion erfolgte durch Coomassie-Färbung. (C) Chromatogramm von hTRBP-His im Komplex<br />
mit si2B. Die Absorption wurde auf eine einheitliche Proteinkonzentration normiert. t R : Retentionszeit.<br />
A D: Fraktionen. *: vermutlich durch ungebundene si2B verursachtes Absorptionsmaximum.<br />
Fraktion D, dessen Signal von Puerbestandteilen verursacht wurde, enthält hingegen keine<br />
nachweisbaren hTRBP-His-Mengen (siehe Abbildung 5.19 B). Dies lässt erkennen, dass <strong>der</strong><br />
gröÿte Teil von hTRBP-His in Lösung in Form von groÿen multimeren Komplexen vorliegt.<br />
Um den Einuss einer <strong>siRNA</strong> auf den Oligomerisierungsgrad von hTRBP-His zu untersuchen,<br />
wurde das Gelltrationsexperiment mit 19,4 µM Protein wie<strong>der</strong>holt (entspricht 87 µg),<br />
das zuvor mit 4,8 µM si2B für 10 min bei 25 ◦ C inkubiert worden war. Bei diesem Protein<strong>siRNA</strong>-Verhältnis<br />
liegt etwa 90 % des Substrates komplexiert vor, wie Gelverzögerungs-Analysen<br />
zeigten (siehe Abschnitt 5.6.2). Ein Vergleich von Abbildung 5.19 B und C zeigt, dass<br />
sich das Chromatogramm von hTRBP-His im Komplex mit si2B nicht wesentlich von demjenigen<br />
ohne si2B unterscheidt. Es ist nur ein zusätzliches Absorptionsmaximum geringer Höhe<br />
bei t R = 32 min erkennbar (*). Der Quotient von A 260 /A 280 beträgt 2,4, was darauf schlieÿen<br />
lässt, dass dieses Signal vermutlich durch ungebundene si2B verursacht wird. Die Ergebnisse<br />
119