Biochemische Charakterisierung der siRNA-vermittelten Erkennung ...
Biochemische Charakterisierung der siRNA-vermittelten Erkennung ...
Biochemische Charakterisierung der siRNA-vermittelten Erkennung ...
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
elative Fluoreszenz<br />
k 1, obs (s -1 )<br />
5 Ergebnisse<br />
und die im Überstand bendlichen Proteine zur Messung <strong>der</strong> Bindungskinetik verwendet.<br />
Bestimmung <strong>der</strong> Assoziation und Dissoziation von dsRNA und hTRBP<br />
Je 50 nM FAM-siLam wurden mit einer konstanten Konzentration hTRBP-His im Bereich von<br />
100 800 nM mit Hilfe einer stopped ow Apparatur rasch gemischt und die Fluoreszenzän<strong>der</strong>ung<br />
aufgezeichnet. Für jede Proteinkonzentration wurden die Daten mathematisch mit Hilfe<br />
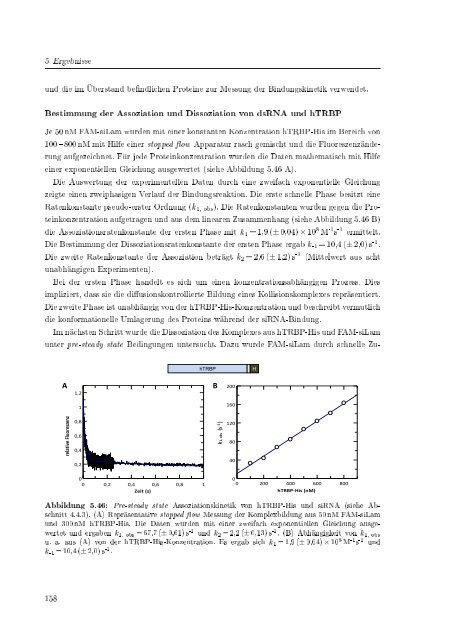
einer exponentiellen Gleichung ausgewertet (siehe Abbildung 5.46 A).<br />
Die Auswertung <strong>der</strong> experimentellen Daten durch eine zweifach exponentielle Gleichung<br />
zeigte einen zweiphasigen Verlauf <strong>der</strong> Bindungsreaktion. Die erste schnelle Phase besitzt eine<br />
Ratenkonstante pseudo-erster Ordnung (k 1, obs ). Die Ratenkonstanten wurden gegen die Proteinkonzentration<br />
aufgetragen und aus dem linearen Zusammenhang (siehe Abbildung 5.46 B)<br />
die Assoziationsratenkonstante <strong>der</strong> ersten Phase mit k 1 = 1,9 (± 0,04) × 10 8 M -1 s -1 ermittelt.<br />
Die Bestimmung <strong>der</strong> Dissoziationsratenkonstante <strong>der</strong> ersten Phase ergab k -1 = 10,4 (± 2,0) s -1 .<br />
Die zweite Ratenkonstante <strong>der</strong> Assoziation beträgt k 2 = 2,6 (± 1,2) s -1 (Mittelwert aus acht<br />
unabhängigen Experimenten).<br />
Bei <strong>der</strong> ersten Phase handelt es sich um einen konzentrationsabhängigen Prozess. Dies<br />
impliziert, dass sie die diusionskontrollierte Bildung eines Kollisionskomplexes repräsentiert.<br />
Die zweite Phase ist unabhängig von <strong>der</strong> hTRBP-His-Konzentration und beschreibt vermutlich<br />
die konformationelle Umlagerung des Proteins während <strong>der</strong> <strong>siRNA</strong>-Bindung.<br />
Im nächsten Schritt wurde die Dissoziation des Komplexes aus hTRBP-His und FAM-siLam<br />
unter pre-steady state Bedingungen untersucht. Dazu wurde FAM-siLam durch schnelle Zu-<br />
hTRBP<br />
H<br />
A<br />
1,2<br />
B<br />
200<br />
1<br />
160<br />
0,8<br />
120<br />
0,6<br />
80<br />
0,4<br />
0,2<br />
40<br />
0<br />
0 0,2 0,4 0,6 0,8 1<br />
Zeit (s)<br />
0<br />
0 200 400 600 800<br />
hTRBP-His (nM)<br />
Abbildung 5.46: Pre-steady state Assoziationskinetik von hTRBP-His und <strong>siRNA</strong> (siehe Abschnitt<br />
4.4.3). (A) Repräsentative stopped ow Messung <strong>der</strong> Komplexbildung aus 50 nM FAM-siLam<br />
und 300 nM hTRBP-His. Die Daten wurden mit einer zweifach exponentiellen Gleichung ausgewertet<br />
und ergaben k 1, obs = 67,7 (± 0,61) s -1 und k 2 = 2,2 (± 0,13) s -1 . (B) Abhängigkeit von k 1, obs<br />
u. a. aus (A) von <strong>der</strong> hTRBP-His-Konzentration. Es ergab sich k 1 = 1,9 (± 0,04) × 10 8 M -1 s -1 und<br />
k -1 = 10,4 (± 2,0) s -1 .<br />
158