Biochemische Charakterisierung der siRNA-vermittelten Erkennung ...
Biochemische Charakterisierung der siRNA-vermittelten Erkennung ...
Biochemische Charakterisierung der siRNA-vermittelten Erkennung ...
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
Mass (%)<br />
Mass (%)<br />
5.5 <strong>Biochemische</strong> <strong>Charakterisierung</strong> von rekombinantem hAgo2<br />
NHA<br />
hAgo2<br />
A<br />
60<br />
50<br />
60<br />
B<br />
1 2<br />
50<br />
40<br />
30<br />
40<br />
30<br />
3<br />
20<br />
20<br />
10<br />
0<br />
0,1 1 10 100 1000<br />
Population<br />
R h<br />
(nm)<br />
Rh (nm)<br />
Pd<br />
(%)<br />
MW-R<br />
(kDa)<br />
Mass<br />
(%)<br />
1 8,7 24,8 531 99,8<br />
2 30,9 0,0 10302 0,2<br />
2<br />
10<br />
0<br />
0,1 1 10 100 1000<br />
Population<br />
R h<br />
(nm)<br />
Rh (nm)<br />
Pd<br />
(%)<br />
MW-R<br />
(kDa)<br />
Mass<br />
(%)<br />
2 53,1 6,3 36652 55,8<br />
3 314,4 13,1 2348440 44,2<br />
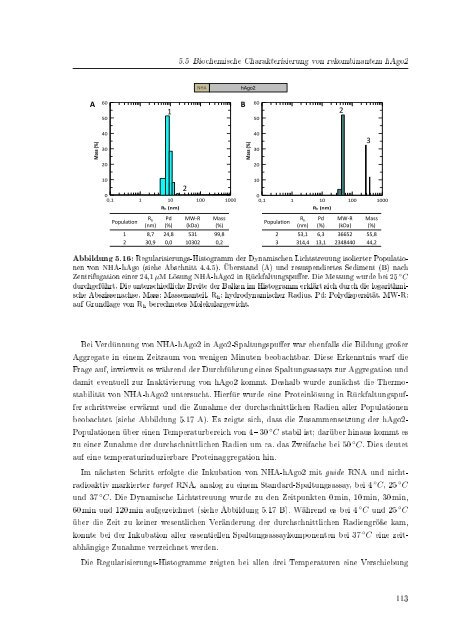
Abbildung 5.16: Regularisierungs-Histogramm <strong>der</strong> Dynamischen Lichtstreuung isolierter Populationen<br />
von NHA-hAgo (siehe Abschnitt 4.4.5). Überstand (A) und resuspendiertes Sediment (B) nach<br />
Zentrifugation einer 24,1 µM Lösung NHA-hAgo2 in Rückfaltungspuer. Die Messung wurde bei 25 ◦ C<br />
durchgeführt. Die unterschiedliche Breite <strong>der</strong> Balken im Histogramm erklärt sich durch die logarithmische<br />
Abszissenachse. Mass: Massenanteil. R h : hydrodynamischer Radius. Pd: Polydispersität. MW-R:<br />
auf Grundlage von R h berechnetes Molekulargewicht.<br />
Bei Verdünnung von NHA-hAgo2 in Ago2-Spaltungspuer war ebenfalls die Bildung groÿer<br />
Aggregate in einem Zeitraum von wenigen Minuten beobachtbar. Diese Erkenntnis warf die<br />
Frage auf, inwieweit es während <strong>der</strong> Durchführung eines Spaltungsassays zur Aggregation und<br />
damit eventuell zur Inaktivierung von hAgo2 kommt. Deshalb wurde zunächst die Thermostabilität<br />
von NHA-hAgo2 untersucht. Hierfür wurde eine Proteinlösung in Rückfaltungspuffer<br />
schrittweise erwärmt und die Zunahme <strong>der</strong> durchschnittlichen Radien aller Populationen<br />
beobachtet (siehe Abbildung 5.17 A). Es zeigte sich, dass die Zusammensetzung <strong>der</strong> hAgo2-<br />
Populationen über einen Temperaturbereich von 4 30 ◦ C stabil ist; darüber hinaus kommt es<br />
zu einer Zunahme <strong>der</strong> durchschnittlichen Radien um ca. das Zweifache bei 50 ◦ C. Dies deutet<br />
auf eine temperaturinduzierbare Proteinaggregation hin.<br />
Im nächsten Schritt erfolgte die Inkubation von NHA-hAgo2 mit guide RNA und nichtradioaktiv<br />
markierter target RNA, analog zu einem Standard-Spaltungsassay, bei 4 ◦ C, 25 ◦ C<br />
und 37 ◦ C. Die Dynamische Lichtstreuung wurde zu den Zeitpunkten 0 min, 10 min, 30 min,<br />
60 min und 120 min aufgezeichnet (siehe Abbildung 5.17 B). Während es bei 4 ◦ C und 25 ◦ C<br />
über die Zeit zu keiner wesentlichen Verän<strong>der</strong>ung <strong>der</strong> durchschnittlichen Radiengröÿe kam,<br />
konnte bei <strong>der</strong> Inkubation aller essentiellen Spaltungsassaykomponenten bei 37 ◦ C eine zeitabhängige<br />
Zunahme verzeichnet werden.<br />
Die Regularisierungs-Histogramme zeigten bei allen drei Temperaturen eine Verschiebung<br />
113