Biochemische Charakterisierung der siRNA-vermittelten Erkennung ...
Biochemische Charakterisierung der siRNA-vermittelten Erkennung ...
Biochemische Charakterisierung der siRNA-vermittelten Erkennung ...
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
Fluoreszenz<br />
Fluoreszenz<br />
5 Ergebnisse<br />
hTRBP<br />
H<br />
A<br />
9000<br />
B<br />
4600<br />
8500<br />
4400<br />
8000<br />
4200<br />
7500<br />
4000<br />
7000<br />
0 200 400 600 800 1000<br />
hTRBP-His (nM)<br />
3800<br />
0 200 400 600 800 1000<br />
hTRBP-His (nM)<br />
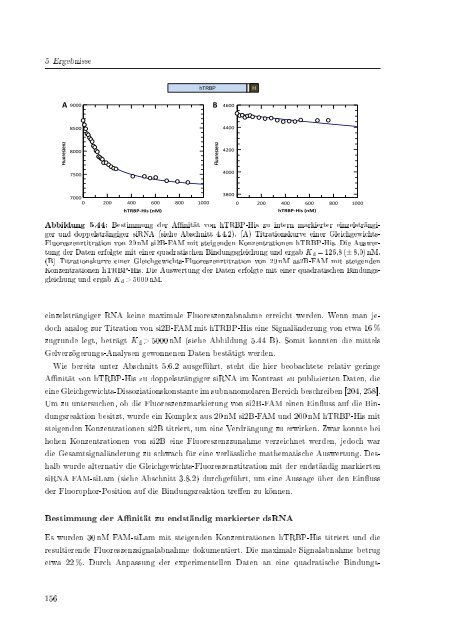
Abbildung 5.44: Bestimmung <strong>der</strong> Afnität von hTRBP-His zu intern markierter einzelsträngiger<br />
und doppelsträngiger <strong>siRNA</strong> (siehe Abschnitt 4.4.2). (A) Titrationskurve einer Gleichgewichts-<br />
Fluoreszenztitration von 20 nM si2B-FAM mit steigenden Konzentrationen hTRBP-His. Die Auswertung<br />
<strong>der</strong> Daten erfolgte mit einer quadratischen Bindungsgleichung und ergab K d = 126,8 (± 8,0) nM.<br />
(B) Titrationskurve einer Gleichgewichts-Fluoreszenztitration von 20 nM as2B-FAM mit steigenden<br />
Konzentrationen hTRBP-His. Die Auswertung <strong>der</strong> Daten erfolgte mit einer quadratischen Bindungsgleichung<br />
und ergab K d > 5000 nM.<br />
einzelsträngiger RNA keine maximale Fluoreszenzabnahme erreicht werden. Wenn man jedoch<br />
analog zur Titration von si2B-FAM mit hTRBP-His eine Signalän<strong>der</strong>ung von etwa 16 %<br />
zugrunde legt, beträgt K d > 5000 nM (siehe Abbildung 5.44 B). Somit konnten die mittels<br />
Gelverzögerungs-Analysen gewonnenen Daten bestätigt werden.<br />
Wie bereits unter Abschnitt 5.6.2 ausgeführt, steht die hier beobachtete relativ geringe<br />
Anität von hTRBP-His zu doppelsträngiger <strong>siRNA</strong> im Kontrast zu publizierten Daten, die<br />
eine Gleichgewichts-Dissoziationskonstante im subnanomolaren Bereich beschreiben [204, 258].<br />
Um zu untersuchen, ob die Fluoreszenzmarkierung von si2B-FAM einen Einuss auf die Bindungsreaktion<br />
besitzt, wurde ein Komplex aus 20 nM si2B-FAM und 200 nM hTRBP-His mit<br />
steigenden Konzentrationen si2B titriert, um eine Verdrängung zu erwirken. Zwar konnte bei<br />
hohen Konzentrationen von si2B eine Fluoreszenzzunahme verzeichnet werden, jedoch war<br />
die Gesamtsignalän<strong>der</strong>ung zu schwach für eine verlässliche mathematische Auswertung. Deshalb<br />
wurde alternativ die Gleichgewichts-Fluoreszenztitration mit <strong>der</strong> endständig markierten<br />
<strong>siRNA</strong> FAM-siLam (siehe Abschnitt 3.8.2) durchgeführt, um eine Aussage über den Einuss<br />
<strong>der</strong> Fluorophor-Position auf die Bindungsreaktion treen zu können.<br />
Bestimmung <strong>der</strong> Anität zu endständig markierter dsRNA<br />
Es wurden 30 nM FAM-siLam mit steigenden Konzentrationen hTRBP-His titriert und die<br />
resultierende Fluoreszenzsignalabnahme dokumentiert. Die maximale Signalabnahme betrug<br />
etwa 22 %. Durch Anpassung <strong>der</strong> experimentellen Daten an eine quadratische Bindungs-<br />
156