- Page 1 and 2: Meccanica Quantistica Prima Parte R
- Page 3 and 4: 4.14 Generalizzazione al caso infin
- Page 5 and 6: Capitolo 1 Introduzione Queste disp
- Page 7 and 8: nostre sensazioni viene arricchito
- Page 9 and 10: 2.1 Il corpo nero Lo studio dell’
- Page 11 and 12: iemettondone una quantità trascura
- Page 13 and 14: un risultato paradossale. Infatti s
- Page 15 and 16: Il valor medio dell’energia si ca
- Page 17 and 18: da cui per T → 0 2 hν cV ≈ 3N
- Page 19 and 20: fotoelettroni vengono emessi dalla
- Page 21 and 22: Inoltre l’energia e l’impulso d
- Page 23 and 24: Figura 2.9: Il dispositivo sperimen
- Page 25 and 26: una struttura uniforme ma deve esse
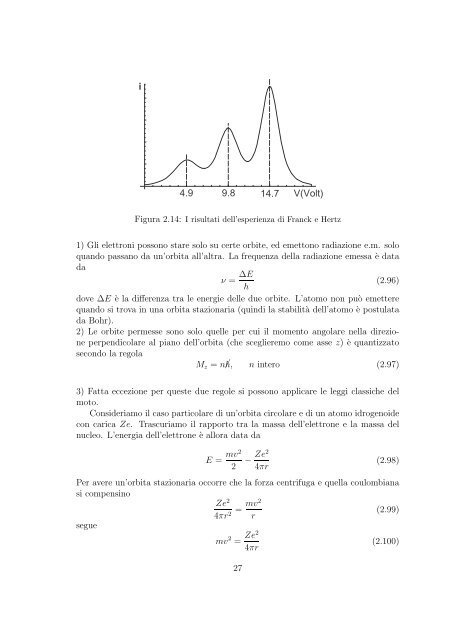
- Page 27 and 28: come valore approssimato del raggio
- Page 29: F G P A Figura 2.13: Il dispositivo
- Page 33 and 34: Figura 2.15: La relazione di De Bro
- Page 35 and 36: Il 17 Gennaio 1926 Schrödinger pub
- Page 37 and 38: dV fosse data da dP = |ψ(x)| 2 dV
- Page 39 and 40: misurare px corrisponde ad un angol
- Page 41 and 42: L’impulso px avrà una indetermin
- Page 43 and 44: E y xxxxxxxxxxxx xxxxxxxxxxxx xxxxx
- Page 45 and 46: L’energia associata ad un momento
- Page 47 and 48: Capitolo 3 L’esperimento di inter
- Page 49 and 50: Figura 3.3: Nella parte destra: cos
- Page 51 and 52: Figura 3.6: Confronto tra le frange
- Page 53 and 54: di vista di Feynamn sia il più usa
- Page 55 and 56: Assiomi per la moltiplicazione con
- Page 57 and 58: (0,1,1) y z (1,1,0) (1,0,1) Figura
- Page 59 and 60: Uno spazio vettoriale sul quale sia
- Page 61 and 62: 4.3 La notazione di Dirac Dirac ha
- Page 63 and 64: Vediamo dunque che Inoltre si ha an
- Page 65 and 66: utilizzare il procedimento di Gram-
- Page 67 and 68: Un esempio un pò più complesso è
- Page 69 and 70: 4.6 Elementi di matrice di un opera
- Page 71 and 72: Vediamo che n Pi = I (4.109) i=1 In
- Page 73 and 74: Questa decomposizione è analoga al
- Page 75 and 76: 4.8 Il problema agli autovalori Com
- Page 77 and 78: D’altra parte, come mostreremo, n
- Page 79 and 80: Prendendo l’equazione aggiunta si
- Page 81 and 82:
4.9.1 Il caso degenere Per capire c
- Page 83 and 84:
il ket corrispondente, avremo |ω =
- Page 85 and 86:
Se definiamo n vettori V (k) con co
- Page 87 and 88:
Notare che A non è né hermitiana
- Page 89 and 90:
da cui B|ai, α〉 ∈ V mi ai (4.2
- Page 91 and 92:
Da cui che ha soluzione 3v1 + v2 +
- Page 93 and 94:
da cui La condizione di normalizzaz
- Page 95 and 96:
a b x x 1 2 Figura 4.7: Il sistema
- Page 97 and 98:
Se adesso espandiamo il vettore |x(
- Page 99 and 100:
corrisponde a uno stato in cui le d
- Page 101 and 102:
Pertanto l’operatore e A risulta
- Page 103 and 104:
con C costante di integrazione. Evi
- Page 105 and 106:
Cioè questi vettori formano un sis
- Page 107 and 108:
Da questa segue Pertanto si dovrà
- Page 109 and 110:
f ε(x) ε Figura 4.11: Esempio di
- Page 111 and 112:
g(x-x') ' Δ x _ Δ 2 1/2 x x Figur
- Page 113 and 114:
Nello spazio infinito-dimensionale
- Page 115 and 116:
segue 〈x|K|x ′ 〉〈x ′ |k
- Page 117 and 118:
Pertanto 〈k|X|g〉 = i dg(k) (4.4
- Page 119 and 120:
Si ha |B| 2 L 2 L = |B| 2π 2 L =
- Page 121 and 122:
Pertanto se A è diagonalizzabile a
- Page 123 and 124:
misura il sistema viene proiettato
- Page 125 and 126:
v) - Se vogliamo informazioni relat
- Page 127 and 128:
In questo caso adotteremo la prescr
- Page 129 and 130:
misurando, lo stato del sistema rim
- Page 131 and 132:
5.3 Come si verifica la teoria quan
- Page 133 and 134:
Esercizio: Dati i seguenti operator
- Page 135 and 136:
e inoltre P(Lx = 0) = |〈Lx = 0|ψ
- Page 137 and 138:
5.5 Variabili compatibili e incompa
- Page 139 and 140:
spazio con Λ avente un autovalore
- Page 141 and 142:
e quindi ψ( x) a Figura 5.1: La fu
- Page 143 and 144:
Pertanto ψ(p) = 〈p|ψ〉 = 〈
- Page 145 and 146:
Pi|ψ〉 ⇔ 〈x1, · · · , xn|P
- Page 147 and 148:
Nel caso di una particella di caric
- Page 149 and 150:
soddisfa l’equazione di Schrödin
- Page 151 and 152:
In questo caso si ha base |p〉 bas
- Page 153 and 154:
e inoltre p = ± √ 2mE (6.7) Abbi
- Page 155 and 156:
Osserviamo anche che nella base del
- Page 157 and 158:
Se calcoliamo la densità di probab
- Page 159 and 160:
Consideriamo una particella confina
- Page 161 and 162:
In ogni caso 2 h/ n En = 2m 2π2 L2
- Page 163 and 164:
Possiamo dividere l’asse delle x
- Page 165 and 166:
Come sappiamo dobbiamo imporre la c
- Page 167 and 168:
dove ρ è la densità di carica, p
- Page 169 and 170:
6.4 Un problema di diffusione: il g
- Page 171 and 172:
V V(x) xxxxxxxxxxxxxxxxxxxxxxxxx xx
- Page 173 and 174:
Pertanto le due soluzioni descrivon
- Page 175 and 176:
Assumiamo (sempre nel caso unidimen
- Page 177 and 178:
Ma a causa del principio di indeter
- Page 179 and 180:
mentre le osservabili diventano dip
- Page 181 and 182:
Pertanto nella base |˜x〉 gli ope
- Page 183 and 184:
Una particella nell’intorno di x0
- Page 185 and 186:
da cui La soluzione generale è ˙p
- Page 187 and 188:
8.1 La soluzione dell’equazione d
- Page 189 and 190:
Notiamo che con da cui bk+2 bk = e
- Page 191 and 192:
Ci sono alcuni punti importanti da
- Page 193 and 194:
Richiedendo che +x0 P(x)dx = 1 (8.
- Page 195 and 196:
A questo fine si introducono due op
- Page 197 and 198:
e scegliendo cn reale e Applicando
- Page 199 and 200:
con A determinata dalla normalizzaz
- Page 201 and 202:
Capitolo 9 Il principio di indeterm
- Page 203 and 204:
vale a dire che integrata dà dψ(x
- Page 205 and 206:
Capitolo 10 Sistemi con N gradi di
- Page 207 and 208:
Vediamo dunque che per spazi vettor
- Page 209 and 210:
I coefficienti dell’espansione di
- Page 211 and 212:
Dividendo per ψE1(x1)ψE2(x2) si h
- Page 213 and 214:
10.3 Più particelle in più dimens
- Page 215 and 216:
sono identiche. D’altra parte, in
- Page 217 and 218:
10.5 Spazi di Hilbert per bosoni e
- Page 219 and 220:
Nel caso fermionico tutto procede a
- Page 221 and 222:
In questo caso la distribuzione mis
- Page 223 and 224:
Capitolo 11 Simmetrie Nel caso clas
- Page 225 and 226:
L’azione di T(ǫ) su uno stato qu
- Page 227 and 228:
dato che una traslazione di a + ǫ
- Page 229 and 230:
Questo implica che se a t = 0 il si
- Page 231 and 232:
ipetere lo stesso esperimento in un
- Page 233 and 234:
Gli autovettori di Π con autovalor
- Page 235 and 236:
si ha 2 Pertanto Pertanto da cui
- Page 237 and 238:
Da cui Questa condizione è soddisf
- Page 239 and 240:
L’equazione di Schrödinger stazi
- Page 241 and 242:
11.6 Rotazioni in tre dimensioni Pr
- Page 243 and 244:
Inoltre se il sistema è invariante
- Page 245 and 246:
con analoga condizione di positivit
- Page 247 and 248:
da cui |〈j, m ′ |J+|j, m〉| 2
- Page 249 and 250:
Da queste ultime si ricavano le esp
- Page 251 and 252:
da cui J k − e imφ f(θ) d k =
- Page 253 and 254:
che ha la proprietà [r, Pr] = ih/
- Page 255 and 256:
Come vedremo in un momento il secon
- Page 257 and 258:
e il suo aggiunto d † d ℓ + 1
- Page 259 and 260:
Ovviamente questo stesso problema i
- Page 261 and 262:
con ET = ECM + E (12.8) Mentre la p
- Page 263 and 264:
Da u ′ ℓ = ρu ′′ ℓ = ∞
- Page 265 and 266:
e quindi a = 2Z n La variabile adim
- Page 267 and 268:
I livelli energetici sono determina
- Page 269 and 270:
L’approssimazione WKB consiste ne
- Page 271 and 272:
problema di connettere le soluzioni
- Page 273 and 274:
Se si considera un moto periodico,
- Page 275 and 276:
Capitolo 14 Teoria delle perturbazi
- Page 277 and 278:
Ponendo a zero i coefficienti di ug
- Page 279 and 280:
e ricordando che si ha X = h/ 2mω
- Page 281 and 282:
Pertanto Esf + E 1 = − Z2 e 2 a0
- Page 283 and 284:
o β 0 〈n , α|H1|n 0 , β〉
- Page 285 and 286:
Capitolo 15 Momento angolare intrin
- Page 287 and 288:
Chiaramente si ha e σ 2 = 4 J 2 =
- Page 289 and 290:
Dunque l’azione dell’operatore
- Page 291 and 292:
e proiettando sulla base |x; j, m
- Page 293 and 294:
Consideriamo adesso il caso di un c
- Page 295 and 296:
In realtà l’espressione corretta
- Page 297 and 298:
separatamente. Dunque l’autovalor
- Page 299 and 300:
e applicare a entrambi i membri l
- Page 301 and 302:
15.3 Operatori tensoriali Abbiamo g
- Page 303 and 304:
15.3.1 Il teorema di Wigner-Eckart