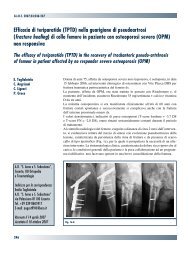
30845 Suppl Giot.pdf - Giornale Italiano di Ortopedia e Traumatologia
30845 Suppl Giot.pdf - Giornale Italiano di Ortopedia e Traumatologia
30845 Suppl Giot.pdf - Giornale Italiano di Ortopedia e Traumatologia
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
DISCuSSIONE<br />
La biocompatibilità <strong>di</strong> un materiale è strettamente correlata alla<br />
capacità <strong>di</strong> adesione delle cellule alla superficie del biomateriale;<br />
la sua topografia, le cariche <strong>di</strong> superficie e i componenti chimici<br />
possono infatti influenzare le caratteristiche delle proteine del<br />
citoscheletro cellulare 8 9 . La <strong>di</strong>mensione dei pori dello scaffold<br />
deve essere adeguata per permettere l’adesione, la migrazione,<br />
la proliferazione e la deposizione del nuovo tessuto osseo 10 . Gli<br />
scaffold che sono stati utilizzati in questo lavoro hanno porosità e<br />
<strong>di</strong>ametro dei pori adeguate, ma non sono perfettamente confrontabili<br />
tra <strong>di</strong> loro: infatti il titanio trabecolare ha porosità inferiore<br />
accompagnata da una <strong>di</strong>mensione dei pori maggiore rispetto agli<br />
scaffold polimerici. L’idrossiapatite è un materiale che è usato da<br />
solo o in combinazione ad altre ceramiche per la fabbricazione <strong>di</strong><br />
scaffold; è stato aggiunto allo scaffold <strong>di</strong> PLGA per fabbricare una<br />
struttura con maggiore rigi<strong>di</strong>tà. Non sembra che la biocompatibilità<br />
<strong>di</strong> questo tipo <strong>di</strong> scaffold sia <strong>di</strong>versa rispetto a quella dello scaffold<br />
<strong>di</strong> solo acido polilattico-co-glicolide; inoltre la capacità <strong>di</strong> <strong>di</strong>fferenziamento<br />
delle ADSC, <strong>di</strong>mostrata dalla deposizione <strong>di</strong> matrice<br />
extracellulare contenente fosfatasi alcalina, è simile nei due tipi <strong>di</strong><br />
scaffold polimerici. Le ADSC cresciute e <strong>di</strong>fferenziate sugli scaffold<br />
<strong>di</strong> titanio trabecolare sembrano secernere una quantità <strong>di</strong> fosfatasi<br />
alcalina significativamente maggiore rispetto a quella secreta<br />
negli scaffold polimerici. Questa <strong>di</strong>fferenza potrebbe essere dovuta<br />
alla <strong>di</strong>versa porosità e <strong>di</strong>mensione dei pori e non al tipo <strong>di</strong> materiale.<br />
I pori <strong>di</strong> <strong>di</strong>mensioni minori presenti negli scaffold polimerici<br />
potrebbero rendere l’apporto <strong>di</strong> sostanze nutritive all’interno della<br />
struttura più <strong>di</strong>fficoltoso, poiché si tratta <strong>di</strong> colture <strong>di</strong> tipo statico.<br />
Tuttavia come mostrano chiaramente le immagini al miscroscopio<br />
a scansione le ADSC sono comunque in grado <strong>di</strong> proliferare negli<br />
scaffold polimerici e <strong>di</strong> secernere abbondante matrice contenente<br />
fosfatasi alcalina che ricopre completamente la struttura.<br />
G. Gastal<strong>di</strong>, et al.<br />
La fosfatasi alcalina è un marker precoce del <strong>di</strong>fferenziamento in<br />
senso osteoblastico: l’espressione del suo gene aumenta già dopo<br />
14 giorni in coltura in terreno osteogenico. Interessante notare che<br />
dopo 14 giorni <strong>di</strong> coltura sia in terreno <strong>di</strong> crescita che in terreno<br />
osteogenico si osserva un aumento <strong>di</strong> pari entità della espressione<br />
della fosfatasi alcalina. Dopo 21 giorni tuttavia, l’espressione si<br />
riduce nelle cellule coltivate in terreno <strong>di</strong> crescita mentre aumenta<br />
fino a 20 volte rispetto al valore a 7 giorni in presenza dei fattori<br />
osteogenici.<br />
BIBLIOGraFIa<br />
1 Wang L, Li Y, Chen X, et al. MCP 1, MIP 1, IL 8 abd ischemic cerebral<br />
tissue enhance human bone marrow stromal cell migration in interface<br />
culture. Hematology 2002;7:113-7.<br />
2 Parekkadan B, van Poll D, Suganuma K, et al. Mesenchymal stem cell drived<br />
molecules reverse fulminant hepatic failure. PLos ONE 2007;2: e941.<br />
3 Gastal<strong>di</strong> G, Asti A,. Scaffino MF, et al. Human a<strong>di</strong>pose-derived stem cells<br />
(hASCs) proliferate and <strong>di</strong>fferentiate in osteoblast-like cells on trabecular<br />
titanium scaffolds. J Biomed Mater Res A 2010;94:790-9.<br />
4 Dorati R, Colonna C, Genta I, et al. Effect of porogen on the physicochemical<br />
properties and degradation performance of PLGA scaffolds. Polymer<br />
Degradation and Stability 2009;1-8 e-first.<br />
5 Lowry OH, Rosenbrough NJ, Farr AL, et al. Protein measurement with the<br />
Folin phenol reagent. J Biol Chem 1951;193: 443-9.<br />
6 Laforenza U, Miceli E, Gastal<strong>di</strong> G, et al. Solute transporters and aquaporins<br />
are impaired in celiac <strong>di</strong>sease. Biol Cell 2010;102:457-67.<br />
7 Barry FP, Murphy JM. Mesenchymal stem cells: clinical applications and<br />
biological characterization. Int J Biochem Cell Biol 2004;36:568-84.<br />
8 Puleo D, Kay CD, Bizios R. Current challenger in cell-biomaterial<br />
interaction. Preface Biomater 1999;20:2201.<br />
9 Verrier S, Blaker JJ, Maquet V, et al. PDLLA/Bioglass composites for<br />
soft-tissue and hard-tissue engineering: an in vitro cell biology assessment.<br />
Biomaterials 2004;5:3013-21.<br />
10 Ni S, Chang J, Chou L. Comparison of osteoblast-like cell responses to<br />
calcium silicate and tricalcium phosphate ceramics in vitro. J Biomed Mater<br />
Res 2007;80:174-83.<br />
S157