MDCK-MRP2 - Dkfz
MDCK-MRP2 - Dkfz
MDCK-MRP2 - Dkfz
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
116<br />
Forschungsschwerpunkt B<br />
Funktionelle und Strukturelle Genomforschung<br />
mit anderen Mitgliedern der AP1-Familie als auch Homodimere,<br />
während c-Fos nur Heterodimere bildet. Nur die Dimer<br />
binden an DNA und aktivieren die Transkription. Deregulation<br />
von AP1 kann zu onkogenen Transformationen führen.<br />
Bis jetzt wurde die Wechselwirkung zwischen Jun und Fos<br />
nicht in vivo beobachtet. Um sie sichtbar zu machen, wurden<br />
c-Jun und c- Fos mit verschiedenen autofluoreszierenden<br />
Proteinen fusioniert und in HeLa-Zellen exprimiert. Die<br />
Wechselwirkung der beiden Proteine wurde dann durch<br />
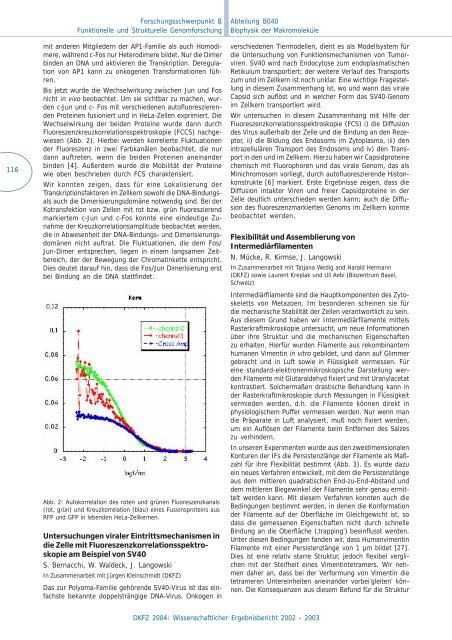
Fluoreszenzkreuzkorrelationsspektroskopie (FCCS) nachgewiesen<br />
(Abb. 2). Hierbei werden korrelierte Fluktuationen<br />
der Fluoreszenz in zwei Farbkanälen beobachtet, die nur<br />
dann auftreten, wenn die beiden Proteinen aneinander<br />
binden [4]. Außerdem wurde die Mobilität der Proteine<br />
wie oben beschrieben durch FCS charakterisiert.<br />
Wir konnten zeigen, dass für eine Lokalisierung der<br />
Transkriptionsfaktoren im Zellkern sowohl die DNA-Bindungsals<br />
auch die Dimerisierungsdomäne notwendig sind. Bei der<br />
Kotransfektion von Zellen mit rot bzw. grün fluoreszierend<br />
markiertem c-Jun und c-Fos konnte eine eindeutige Zunahme<br />
der Kreuzkorrelationsamplitude beobachtet werden,<br />
die in Abwesenheit der DNA-Bindungs- und Dimerisierungsdomänen<br />
nicht auftrat. Die Fluktuationen, die dem Fos/<br />
Jun-Dimer entsprechen, liegen in einem langsamen Zeitbereich,<br />
der der Bewegung der Chromatinkette entspricht.<br />
Dies deutet darauf hin, dass die Fos/Jun Dimerisierung erst<br />
bei Bindung an die DNA stattfindet.<br />
Abb. 2: Autokorrelation des roten und grünen Fluoreszenzkanals<br />
(rot, grün) und Kreuzkorrelation (blau) eines Fusionsproteins aus<br />
RFP und GFP in lebenden HeLa-Zellkernen.<br />
Untersuchungen viraler Eintrittsmechanismen in<br />
die Zelle mit Fluoreszenzkorrelationsspektroskopie<br />
am Beispiel von SV40<br />
S. Bernacchi, W. Waldeck, J. Langowski<br />
In Zusammenarbeit mit Jürgen Kleinschmidt (DKFZ)<br />
Das zur Polyoma-Familie gehörende SV40-Virus ist das einfachste<br />
bekannte doppelsträngige DNA-Virus. Onkogen in<br />
Abteilung B040<br />
Biophysik der Makromoleküle<br />
DKFZ 2004: Wissenschaftlicher Ergebnisbericht 2002 - 2003<br />
verschiedenen Tiermodellen, dient es als Modellsystem für<br />
die Untersuchung von Funktionsmechanismen von Tumorviren.<br />
SV40 wird nach Endocytose zum endoplasmatischen<br />
Retikulum transportiert; der weitere Verlauf des Transports<br />
zum und im Zellkern ist noch unklar. Eine wichtige Fragestellung<br />
in diesem Zusammenhang ist, wo und wann das virale<br />
Capsid sich auflöst und in welcher Form das SV40-Genom<br />
im Zellkern transportiert wird.<br />
Wir untersuchen in diesem Zusammenhang mit Hilfe der<br />
Fluoreszenzkorrelationsspektroskopie (FCS) i) die Diffusion<br />
des Virus außerhalb der Zelle und die Bindung an den Rezeptor,<br />
ii) die Bildung des Endosoms im Zytoplasma, iii) den<br />
intrazellulären Transport des Endosoms und iv) den Transport<br />
in den und im Zellkern. Hierzu haben wir Capsidproteine<br />
chemisch mit Fluorophoren und das virale Genom, das als<br />
Minichromosom vorliegt, durch autofluoreszierende Histonkonstrukte<br />
[6] markiert. Erste Ergebnisse zeigen, dass die<br />
Diffusion intakter Viren und freier Capsidproteine in der<br />
Zelle deutlich unterschieden werden kann; auch die Diffusion<br />
des fluoreszenzmarkierten Genoms im Zellkern konnte<br />
beobachtet werden.<br />
Flexibilität und Assemblierung von<br />
Intermediärfilamenten<br />
N. Mücke, R. Kirmse, J. Langowski<br />
In Zusammenarbeit mit Tatjana Wedig and Harald Hermann<br />
(DKFZ) sowie Laurent Kreplak und Uli Aebi (Biozentrum Basel,<br />
Schweiz)<br />
Intermediärfilamente sind die Hauptkomponenten des Zytoskeletts<br />
von Metazoen. Im besonderen scheinen sie für<br />
die mechanische Stabilität der Zellen verantwortlich zu sein.<br />
Aus diesem Grund haben wir Intermediärfilamente mittels<br />
Rasterkraftmikroskopie untersucht, um neue Informationen<br />
über ihre Struktur und die mechanischen Eigenschaften<br />
zu erhalten. Hierfür wurden Filamente aus rekombinantem<br />
humanen Vimentin in vitro gebildet, und dann auf Glimmer<br />
gebracht und in Luft sowie in Flüssigkeit vermessen. Für<br />
eine standard-elektronenmikroskopische Darstellung werden<br />
Filamente mit Glutaraldehyd fixiert und mit Uranylacetat<br />
kontrastiert. Solchermaßen drastische Behandlung kann in<br />
der Rasterkraftmikroskopie durch Messungen in Flüssigkeit<br />
vermieden werden, d.h. die Filamente können direkt in<br />
physiologischem Puffer vermessen werden. Nur wenn man<br />
die Präparate in Luft analysiert, muß noch fixiert werden,<br />
um ein Auflösen der Filamente beim Entfernen des Salzes<br />
zu verhindern.<br />
In unseren Experimenten wurde aus den zweidimensionalen<br />
Konturen der IFs die Persistenzlänge der Filamente als Maßzahl<br />
für ihre Flexibilität bestimmt (Abb. 3). Es wurde dazu<br />
ein neues Verfahren entwickelt, mit dem die Persistenzlänge<br />
aus dem mittleren quadratischen End-zu-End-Abstand und<br />
dem mittleren Biegewinkel der Filamente sehr genau ermittelt<br />
werden kann. Mit diesem Verfahren konnten auch die<br />
Bedingungen bestimmt werden, in denen die Konformation<br />
der Filamente auf der Oberfläche im Gleichgewicht ist, so<br />
dass die gemessenen Eigenschaften nicht durch schnelle<br />
Bindung an die Oberfläche (‚trapping’) beeinflusst werden.<br />
Unter diesen Bedingungen fanden wir, dass Humanvimentin<br />
Filamente mit einer Persistenzlänge von 1 µm bildet [27].<br />
Dies ist eine relativ starre Struktur, jedoch flexibel verglichen<br />
mit der Steifheit eines Vimentintetramers. Wir nehmen<br />
daher an, dass bei der Verformung von Vimentin die<br />
tetrameren Untereinheiten aneinander vorbei’gleiten’ können.<br />
Die Konsequenzen aus diesem Befund für die Struktur