MDCK-MRP2 - Dkfz
MDCK-MRP2 - Dkfz
MDCK-MRP2 - Dkfz
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
402<br />
Zelldifferenzierung (F050)<br />
Leiter: Prof. Dr. med.vet. Angel Alonso<br />
Forschungsschwerpunkt F<br />
Infektion und Krebs<br />
Gastwissenschaftler<br />
Dr. Ignacio G. Bravo (8/02- , Span. Kultusministerium)<br />
Dr. Kirsten Kabsch (- 6/02, DFG)<br />
Doktorandinnen<br />
Kerstin Leykauf (-12/03, DFG)<br />
Myriam Grüner (6/02- , DKFZ)<br />
Diplomand<br />
Adriano Lavecchia (6/02- )<br />
Techniker<br />
Jürgen Fischer<br />
Michaela Hipp<br />
Das E5 Protein der menschlichen Papillomaviren.<br />
Struktur und Funktion<br />
A. Alonso, I.G. Bravo, K. Kabsch<br />
In Kooperation mit: Prof. Dr. J. Reed, DKFZ; Priv. Doz. Dr. J.<br />
Schenkel, Institut für Physiologie, Universität Heidelberg; Priv.<br />
Doz. Dr. M. Kaszkin, Institut für Pharmakologie, Universität<br />
Frankfurt; Prof. Dr. M. Dürst, Frauenklinik der Universität Jena.<br />
Betrachtet man die Genomstruktur der menschlichen Papillomaviren,<br />
so findet man eine Reihe von offenen Leserahmen<br />
zwischen den bekannten Genen E2 und L2. Über<br />
die Bedeutung dieser potentiellen Proteine ist wenig bekannt;<br />
unbekannt ist auch, ob solche Leserahmen überhaupt<br />
in vivo transkribiert werden. In den “high-risk” HPVs<br />
dieser Region ist nur ein offenes Leseraster enthalten, das<br />
für ein Protein mit ungefähr 80 Aminosäuren kodiert. Dieses<br />
Protein wurde E5 genannt. E5 von HPV16, 18 und 33 ist<br />
in der Lage, Zellen zu transformieren, nicht aber zu malignisieren.<br />
Darüber hinaus kooperiert E5 mit E7 und verstärkt<br />
damit die Transformationseigenschaften des E7 Proteins.<br />
E5 kann nicht als ein Onkogen betrachtet werden, kann<br />
aber die Eigenschaften der HPV-infizierten Zellen so verändern,<br />
dass es zu einer Instabilisierung dieser Zellen kommt.<br />
Diese Destabilisierung ist die Basis für die spätere Einwirkung<br />
der E6 und E7 Onkogene.<br />
HPV16-E5 ist ein stark hydrophobes Protein, 83 Aminosäuren<br />
lang und vorwiegend in Endosomen, Golgi und ER lokalisiert.<br />
Die hohe Hydrophobizität hat bis heute die Produktion<br />
von Antikörpern erschwert, so dass Experimente entweder<br />
mit Epitop-gebundenen E5 Proteinen oder mit in vitro syn-<br />
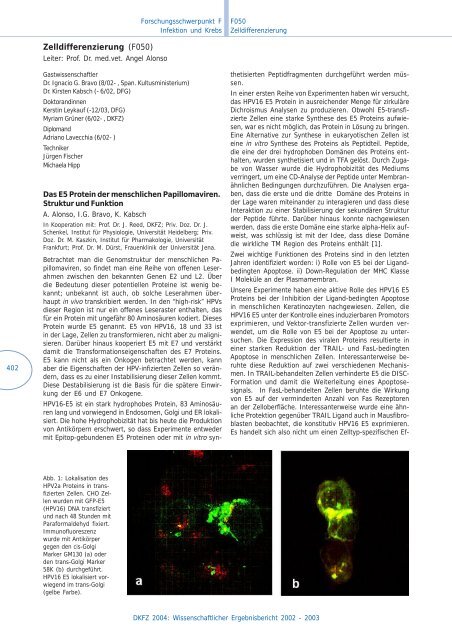
Abb. 1: Lokalisation des<br />
HPV2a Proteins in transfizierten<br />
Zellen. CHO Zellen<br />
wurden mit GFP-E5<br />
(HPV16) DNA transfiziert<br />
und nach 48 Stunden mit<br />
Paraformaldehyd fixiert.<br />
Immunofluoreszenz<br />
wurde mit Antikörper<br />
gegen den cis-Golgi<br />
Marker GM130 (a) oder<br />
den trans-Golgi Marker<br />
58K (b) durchgeführt.<br />
HPV16 E5 lokalisiert vorwiegend<br />
im trans-Golgi<br />
(gelbe Farbe).<br />
F050<br />
Zelldifferenzierung<br />
DKFZ 2004: Wissenschaftlicher Ergebnisbericht 2002 - 2003<br />
thetisierten Peptidfragmenten durchgeführt werden müssen.<br />
In einer ersten Reihe von Experimenten haben wir versucht,<br />
das HPV16 E5 Protein in ausreichender Menge für zirkuläre<br />
Dichroismus Analysen zu produzieren. Obwohl E5-transfizierte<br />
Zellen eine starke Synthese des E5 Proteins aufwiesen,<br />
war es nicht möglich, das Protein in Lösung zu bringen.<br />
Eine Alternative zur Synthese in eukaryotischen Zellen ist<br />
eine in vitro Synthese des Proteins als Peptidteil. Peptide,<br />
die eine der drei hydrophoben Domänen des Proteins enthalten,<br />
wurden synthetisiert und in TFA gelöst. Durch Zugabe<br />
von Wasser wurde die Hydrophobizität des Mediums<br />
verringert, um eine CD-Analyse der Peptide unter Membranähnlichen<br />
Bedingungen durchzuführen. Die Analysen ergaben,<br />
dass die erste und die dritte Domäne des Proteins in<br />
der Lage waren miteinander zu interagieren und dass diese<br />
Interaktion zu einer Stabilisierung der sekundären Struktur<br />
der Peptide führte. Darüber hinaus konnte nachgewiesen<br />
werden, dass die erste Domäne eine starke alpha-Helix aufweist,<br />
was schlüssig ist mit der Idee, dass diese Domäne<br />
die wirkliche TM Region des Proteins enthält [1].<br />
Zwei wichtige Funktionen des Proteins sind in den letzten<br />
Jahren identifiziert worden: i) Rolle von E5 bei der Ligandbedingten<br />
Apoptose. ii) Down-Regulation der MHC Klasse<br />
I Moleküle an der Plasmamembran.<br />
Unsere Experimente haben eine aktive Rolle des HPV16 E5<br />
Proteins bei der Inhibition der Ligand-bedingten Apoptose<br />
in menschlichen Keratinozyten nachgewiesen. Zellen, die<br />
HPV16 E5 unter der Kontrolle eines induzierbaren Promotors<br />
exprimieren, und Vektor-transfizierte Zellen wurden verwendet,<br />
um die Rolle von E5 bei der Apoptose zu untersuchen.<br />
Die Expression des viralen Proteins resultierte in<br />
einer starken Reduktion der TRAIL- und FasL-bedingten<br />
Apoptose in menschlichen Zellen. Interessanterweise beruhte<br />
diese Reduktion auf zwei verschiedenen Mechanismen.<br />
In TRAIL-behandelten Zellen verhinderte E5 die DISC-<br />
Formation und damit die Weiterleitung eines Apoptosesignals.<br />
In FasL-behandelten Zellen beruhte die Wirkung<br />
von E5 auf der verminderten Anzahl von Fas Rezeptoren<br />
an der Zelloberfläche. Interessanterweise wurde eine ähnliche<br />
Protektion gegenüber TRAIL Ligand auch in Mausfibroblasten<br />
beobachtet, die konstitutiv HPV16 E5 exprimieren.<br />
Es handelt sich also nicht um einen Zelltyp-spezifischen Ef-