MDCK-MRP2 - Dkfz
MDCK-MRP2 - Dkfz
MDCK-MRP2 - Dkfz
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
Forschungsschwerpunkt F<br />
Infektion und Krebs<br />
fekt und kann deshalb als Reaktionsmechanismus des Virus<br />
auf die Apotoseversuche der Zelle verstanden werden [2].<br />
Eine wichtige Beobachtung war, dass die Expression von<br />
E5 die Zellen gegen Stressfaktoren sensibilisiert, möglicherweise<br />
durch eine Veränderung der Membranfluidität, die<br />
durch die Inkorporation des viralen Proteins in die Membran<br />
verursacht wird [3].<br />
Ein weiterer Effekt des E5 Proteins ist eine Verringerung<br />
der Expression von MHC KlasseI Molekülen an der Membran.<br />
In Zellen, die transient mit HPV2a E5 transfiziert worden<br />
waren, konnten wir beweisen, dass der Gehalt an Membrangebundenen<br />
MHC Klasse I stark reduziert war. Interessanterweise<br />
war die Gesamtmenge an MHCs in E5-exprimierenden<br />
und Kontrolltransfektanten gleich, so dass wahrscheinlich<br />
ein defekter Transport des Komplexes an die Membran für<br />
den Effekt verantwortlich war [4].<br />
Diese Ergebnisse deuten daraufhin, dass E5 nicht in der<br />
Lage ist, Zellen zu transformieren oder malignisieren, sondern<br />
eher zu “entstabilisieren”. Diese “Entstabilisierung” wird<br />
zum einen durch die Verhinderung der Apoptose infizierter<br />
Zellen erreicht, zum anderen durch eine verringerte Membranexpression<br />
der MHC Moleküle und, dadurch bedingt,<br />
eine reduzierte immunologische Antwort auf die Präsenz<br />
des viralen Proteins.<br />
Transaktivierung der EGF Rezeptoren<br />
A. Alonso, I.G. Bravo, X. Mao, K. Leykauf,<br />
A. LaVecchia<br />
In Kooperation mit Prof. Dr. J. Kartenbeck, Prof. Dr.<br />
W.D. Lehmann, DKFZ.<br />
Neben der Ligand-abhängigen Aktivierung der EGF-Rezeptoren<br />
wurde in den letzten Zeiten eine Ligand-unabhängige<br />
Aktivierung beschrieben. Diese Aktivierung erfolgt in menschlichen<br />
Keratinozyten durch externe Einflüsse und Stress-<br />
Bedingungen, wie UV-Licht, Zytokine oder Hyperosmolari-<br />
F050<br />
Zelldifferenzierung<br />
tät. Die Mechanismen, die dieser sogenannten “Rezeptor<br />
trans-Aktivierung” zugrunde liegen, sind bis heute nicht<br />
geklärt. Ob diese “trans-Aktivierung” durch indirekte Einwirkung<br />
von Wachstumsfaktoren zustande kommt, ist bis heute<br />
unbekannt. Sicher ist aber, dass auch Wachstumsfaktoren-unabhängige<br />
Aktivierungsprozesse in der Zelle häufig<br />
zu finden sind.<br />
In einer Reihe von Untersuchungen konnten wir beobachten,<br />
dass osmotischer Schock bei menschlichen Keratinozyten<br />
zu einer starken Aktivierung der EGF-Rezeptoren führt<br />
[5]. Die Analyse der Mechanismen dieser Aktivierung zeigte,<br />
dass die Tyrosinphosphorylierung durch eine Inaktivierung<br />
der EGFR-spezifischen Phosphatase erfolgt. Dadurch wird<br />
die Herunterregulation der Kinaseaktivität verhindert und<br />
die Aktivierung der “down-stream” Kinasekaskaden-Wege<br />
nicht abgeschaltet. Unsere Ergebnisse haben bewiesen,<br />
dass dieser Effekt durch Stresskinase p38 vermittelt wird.<br />
Gleichzeitig mit der Aktivierung der Stresskinase ist eine<br />
starke Desorganisation des Zytoskeletts zu beobachten.<br />
Diese Desorganisation ist parallel zu einer Inhibition der EGFRspezifischen<br />
Phosphatasen, die möglicherweise mit dem<br />
Aktin-Zytoskelett assoziiert sind. Dieser Effekt ist wahrscheinlich<br />
durch eine Stress-bedingte Aktivierung von<br />
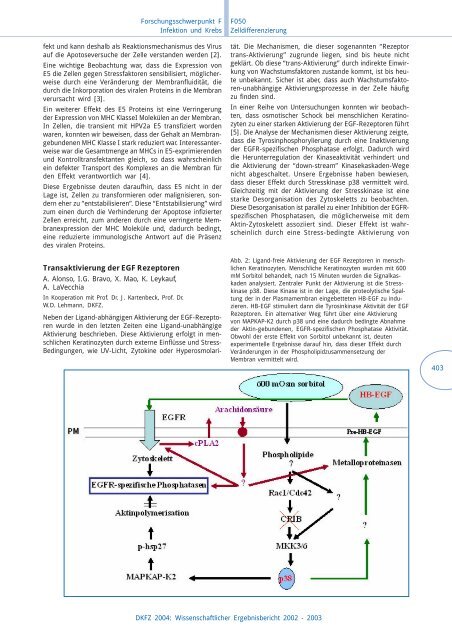
Abb. 2: Ligand-freie Aktivierung der EGF Rezeptoren in menschlichen<br />
Keratinozyten. Menschliche Keratinozyten wurden mit 600<br />
mM Sorbitol behandelt, nach 15 Minuten wurden die Signalkaskaden<br />
analysiert. Zentraler Punkt der Aktivierung ist die Stresskinase<br />
p38. Diese Kinase ist in der Lage, die proteolytische Spaltung<br />
der in der Plasmamembran eingebetteten HB-EGF zu induzieren.<br />
HB-EGF stimuliert dann die Tyrosinkinase Aktivität der EGF<br />
Rezeptoren. Ein alternativer Weg führt über eine Aktivierung<br />
von MAPKAP-K2 durch p38 und eine dadurch bedingte Abnahme<br />
der Aktin-gebundenen, EGFR-spezifischen Phosphatase Aktivität.<br />
Obwohl der erste Effekt von Sorbitol unbekannt ist, deuten<br />
experimentelle Ergebnisse darauf hin, dass dieser Effekt durch<br />
Veränderungen in der Phospholipidzusammensetzung der<br />
Membran vermittelt wird.<br />
DKFZ 2004: Wissenschaftlicher Ergebnisbericht 2002 - 2003<br />
403